Ovaj odjeljak opisuje genetske karakteristike različitih živih organizama.
Opće informacije
Sa paradoksom- dužina genoma ne zavisi od složenosti organizma.
Uporedne veličine genoma u različitim grupama organizama.
| Objekt | veličina genoma, bp | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mikoplazme | 10 4 -10 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eubakterije (E.coli) | 10 5 -10 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pečurke | (2-5)x10 7 |
| Pogled | Broj gena | Dužina genoma, bp |
| Eubacteria | ||
| Mycoplasma genitalium | 477 | 580.070 |
| Synechocystis sp. | 3168 | 3573 hiljade |
| E.coli | 4280 | 4.639.221 |
| Helicobacter pylori | 1590 | 1667 hiljada |
| Bacillus subtilis | 4099 | 4214 hiljada |
| Aquifex aelolicus | 1544 | 1551 hiljada |
| Mycobacterium tuberculosis | 4402 | 4447 hiljada |
| Treponema pallidum | 1041 | 1138 hiljada |
| Rickettsia prowazekii | 834 | 1111 hiljada |
| Thermotoga maritima | 1877 | 1860 hiljada |
| Archaea | ||
| Methanococcus sannaschii | 1750 | 1664 hiljade |
| Archaeoglobus fulgidus | 2493 | 2178 hiljada |
| Aeropyrum pernix | 2620 | 669 hiljada |
| Eukarioti | ||
| Saccharomyces cerevisiae | ~6300 | 12.069 hiljada |
| Arabidopsis thaliana | ~26000 | 142.000 hiljada |
| Caenorhabditis elegans | ~19000 | 97.000 hiljada |
| Drosophila melanogaster | ~14000 | 137.000 hiljada |
| X.laevis | ||
| Homo sapiens | ~30000 | 3.200.000 hiljada |
Eukariotski genom
Ljudski genom
Ljudi imaju 23 para hromozoma, 22 autosoma i 1 par polnih hromozoma XX (ženski) ili XY (muški).
Haploidni ljudski genom uključuje više od 3 milijarde baznih parova DNK, ukupne dužine od približno 1,8 m. Ukupna količina informacija zabilježenih u ljudskoj DNK zauzima oko 750 megabajta.
Haploidni ljudski genom sadrži otprilike 20.000-25.000 gena koji kodiraju proteine.
Oko 1,5% genoma kodira proteine, dok ostatak DNK uključuje regulatorne sekvence, introne, sekvence koje kodiraju RNK, različita ponavljanja, itd.
~8% genoma se sastoji od inaktiviranih sekvenci nekada funkcionalnih retrovirusa HERV (Human endogenous retrovirus), od kojih je najmlađi, HERV-K, star oko 5 miliona godina.
Francuski istraživači su rekonstruisali sekvencu jednog od retrovirusa iz porodice HERV-K koji se nalazi u genomu. U ćelijama linije 239T došlo je do transkripcije virusne DNK i proizvodnje virusnih čestica. Štaviše, pokazalo se da je sam virus, nazvan Phoenix, sposoban samostalno provesti kompletan retrovirusni ciklus od infekcije stanice do integracije u genom i sklapanja virusnih čestica. Neki tumori, kao što su teratokarcinom i melanom, eksprimiraju različite HERV proteine. Ovo nije dovoljno za sastavljanje punopravnog virusa - previše je mutacija. Međutim, "uskrsnuće" punopravnog virusa može se dogoditi zbog spontane rekombinacije - temeljnu mogućnost toga potvrđuju rezultati francuskih naučnika.
| hromozom | Genov | Dužina, pon | Sekvencirano |
| 1 | 3,148 | 247,200,000 | 224,999,719 |
| 2 | 902 | 242,750,000 | 237,712,649 |
| 3 | 1,436 | 199,450,000 | 194,704,827 |
| 4 | 453 | 191,260,000 | 187,297,063 |
| 5 | 609 | 180,840,000 | 177,702,766 |
| 6 | 1,585 | 170,900,000 | 167,273,992 |
| 7 | 1,824 | 158,820,000 | 154,952,424 |
| 8 | 781 | 146,270,000 | 142,612,826 |
| 9 | 1,229 | 140,440,000 | 120,312,298 |
| 10 | 1,312 | 135,370,000 | 131,624,737 |
| 11 | 405 | 134,450,000 | 131,130,853 |
| 12 | 1,330 | 132,290,000 | 130,303,534 |
| 13 | 623 | 114,130,000 | 95,559,980 |
| 14 | 886 | 106,360,000 | 88,290,585 |
| 15 | 676 | 100,340,000 | 81,341,915 |
| 16 | 898 | 88,820,000 | 78,884,754 |
| 17 | 1,367 | 78,650,000 | 77,800,220 |
| 18 | 365 | 76,120,000 | 74,656,155 |
| 19 | 1,553 | 63,810,000 | 55,785,651 |
| 20 | 816 | 62,440,000 | 59,505,254 |
| 21 | 446 | 46,940,000 | 34,171,998 |
| 22 | 595 | 49,530,000 | 34,893,953 |
| X | 1,093 | 154,910,000 | 151,058,754 |
| Y | 125 | 57,740,000 | 22,429,293 |
Genom šimpanze
Drosophila genom
Genom nematode
Mitohondrijski genom
DNK u mitohondrijima predstavljena je cikličkim molekulima koji ne stvaraju veze sa histonima; u tom pogledu nalikuju bakterijskim hromozomima.
Kod ljudi, mitohondrijska DNK sadrži 16,5 hiljada bp, potpuno je dešifrovana. Utvrđeno je da je mitohondrijska DNK različitih objekata vrlo homogena, a razlika je samo u veličini introna i netranskribiranih regija. Sva mitohondrijska DNK je predstavljena u više kopija, sakupljenih u grupe ili klastere. Dakle, jedna mitohondrija jetre štakora može sadržavati od 1 do 50 cikličkih molekula DNK. Ukupna količina mitohondrijske DNK po ćeliji je oko jedan posto. Sinteza mitohondrijalne DNK nije povezana sa sintezom DNK u jezgru. Kao i kod bakterija, mitohondrijska DNK se sakuplja u posebnoj zoni - nukleoidu, čija je veličina oko 0,4 mikrona u prečniku. Duge mitohondrije mogu imati od 1 do 10 nukleoida. Kada se duga mitohondrija podijeli, dio koji sadrži nukleoid se odvaja od njega (slično binarnoj fisiji bakterija). Količina DNK u pojedinačnim mitohondrijskim nukleoidima može varirati i do 10 puta u zavisnosti od tipa ćelije. Kada se mitohondrije spoje, njihove unutrašnje komponente se mogu zamijeniti.
rRNA i ribozomi mitohondrija se oštro razlikuju od onih u citoplazmi. Ako se ribozomi 80-ih nalaze u citoplazmi, onda ribozomi mitohondrija biljnih ćelija pripadaju ribozomima 70-ih (sastoje se od 30-ih i 50-ih podjedinica, sadrže 16-s i 23-e RNK, karakteristične za prokariotske ćelije), a manji ribozomi (oko 50-ih) nalaze se u citoplazmi. mitohondrije životinjskih ćelija. U mitoplazmi se sinteza proteina odvija na ribosomima. Zaustavlja se, za razliku od sinteze na citoplazmatskim ribosomima, pod djelovanjem antibiotika hloramfenikola, koji potiskuje sintezu proteina u bakterijama.
Transfer RNA se također sintetizira na mitohondrijskom genomu; sintetiziraju se ukupno 22 tRNA. Triplet kod mitohondrijalnog sintetičkog sistema razlikuje se od onog koji se koristi u hijaloplazmi. Unatoč prisutnosti naizgled svih komponenti potrebnih za sintezu proteina, male molekule mitohondrijske DNK ne mogu kodirati sve mitohondrijske proteine, već samo mali dio njih. Dakle, DNK je veličine 15 hiljada bp. može kodirati proteine ukupne molekularne težine od oko 6x105. Istovremeno, ukupna molekularna težina proteina čestice kompletnog respiratornog ansambla mitohondrija dostiže vrijednost od oko 2x106.
Rice. Relativne veličine mitohondrija u različitim organizmima.
Zanimljivo je posmatrati sudbinu mitohondrija u ćelijama kvasca. U aerobnim uslovima, ćelije kvasca imaju tipične mitohondrije sa jasno definisanim kristama. Kada se ćelije prenesu u anaerobne uslove (na primer, kada su podkulture ili kada se prenesu u atmosferu azota), tipične mitohondrije se ne detektuju u njihovoj citoplazmi, već su vidljive male membranske vezikule. Pokazalo se da u anaerobnim uslovima ćelije kvasca ne sadrže kompletan respiratorni lanac (citokromi b i a su odsutni). Kada se kultura prozrači, dolazi do brze indukcije biosinteze respiratornih enzima, naglog povećanja potrošnje kisika, a u citoplazmi se pojavljuju normalne mitohondrije.
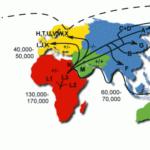
Naseljavanje ljudi na Zemlji 
Plastidni genom
Poput mitohondrija, hloroplasti imaju vlastiti genetski sistem koji osigurava sintezu određenog broja proteina unutar samih plastida. DNK, različite RNK i ribozomi nalaze se u matriksu hloroplasta. Pokazalo se da se DNK hloroplasta oštro razlikuje od DNK jezgra. Predstavljen je cikličkim molekulima dužine do 40-60 mikrona, sa molekulskom težinom od 0,8-1,3x108 daltona. U jednom hloroplastu može biti mnogo kopija DNK. Dakle, u pojedinačnom hloroplastu kukuruza postoji 20-40 kopija molekula DNK. Trajanje ciklusa i brzina replikacije nuklearne i hloroplastne DNK, kao što je pokazano u ćelijama zelenih algi, ne poklapaju se. DNK hloroplasta nije u kompleksu sa histonima. Sve ove karakteristike DNK hloroplasta bliske su karakteristikama DNK prokariotskih ćelija. Štaviše, sličnost DNK hloroplasta i bakterija dodatno je pojačana činjenicom da su glavne transkripcione regulatorne sekvence (promotori, terminatori) iste. Sve vrste RNK (glasnik, transfer, ribosomska) se sintetiziraju na DNK hloroplasta. DNK hloroplasta kodira rRNA, koja je dio ribozoma ovih plastida, koji pripadaju prokariotskom 70S tipu (sadrže 16S i 23S rRNA). Ribozomi hloroplasta su osjetljivi na antibiotik hloramfenikol, koji inhibira sintezu proteina u prokariotskim stanicama.
pirinač.
Formiranje ukosnica u DNK nekih hloroplasta.
Baš kao iu slučaju hloroplasta, ponovo smo suočeni sa
postojanje posebnog sistema za sintezu proteina, različitog od
jedan u kavezu.
Ova otkrića su obnovila interesovanje za teoriju simbiotike
porijeklo hloroplasta. Ideja da hloroplasti
nastao zbog kombinacije heterotrofnih stanica s prokariotskim
plavo-zelene alge, izražene na prijelazu iz XIX u XX
vekovima (A.S. Fomincin, K.S. Merezhkovsky) ponovo pronalazi svoje
potvrdu. Ovu teoriju podržava nešto iznenađujuće.
sličnosti u strukturi hloroplasta i plavo-zelenih algi,
sličnost sa njihovim glavnim funkcionalnim karakteristikama, i
prvenstveno sa sposobnošću fotosintetskih procesa.
pirinač. Sastav genoma plastida u Arabidopsisu.
Poznate su brojne činjenice prave endosimbioze plavo-zelenih
alge sa stanicama nižih biljaka i protozoa, gdje
funkcioniraju i opskrbljuju ćeliju domaćina proizvodima fotosinteze.
Pokazalo se da se mogu odabrati i izolirani hloroplasti
neke ćelije i koriste ih kao endosimbione.
Kod mnogih beskičmenjaka (rotiferi, mekušci) koji se hrane
više alge, koje vare, netaknute
hloroplasti se nalaze unutar ćelija probavnih žlijezda.
Tako su kod nekih biljojeda pronađene ćelije mekušaca
netaknuti hloroplasti s funkcionalnim fotosintetskim stanicama
sistema, čija je aktivnost praćena uključivanjem C14O2.
Kako se pokazalo, hloroplasti se mogu uvesti u citoplazmu
ćelije kulture mišjih fibroblasta pinocitozom. kako god
nisu bile napadnute hidrolazama. Takve ćelije, koje uključuju
zeleni hloroplasti, mogu se dijeliti pet generacija,
dok su hloroplasti ostali netaknuti i izvedeni
fotosintetske reakcije. Učinjeni su pokušaji kultivacije
hloroplasti u umjetnom okruženju: hloroplasti mogu fotosintetizirati,
U njima se odvijala sinteza RNK, ostali su netaknuti 100 sati,
podjele su uočene čak i unutar 24 sata. Ali onda se to dogodilo
pad aktivnosti hloroplasta i oni su umrli.
Ova zapažanja i brojne biohemijske studije su pokazale
da su i one karakteristike autonomije koje poseduju hloroplasti
nedovoljno za dugoročno održavanje njihovih funkcija i tema
više za njihovu reprodukciju.
Nedavno je bilo moguće potpuno dešifrirati cijeli niz
nukleotidi u cikličkoj DNK molekuli hloroplasta
viših biljaka. Ova DNK može kodirati do 120 gena,
među njima: 4 gena ribosomske RNK, 20 hloroplastnih ribosomalnih proteina,
geni nekih podjedinica hloroplastne RNA polimeraze, nekoliko
proteini I i II fotosistema, 9 od 12 podjedinica ATP sintetaze,
dijelovi proteina kompleksa lanca transporta elektrona, jedan
iz podjedinica ribuloza difosfat karboksilaze (ključni enzim
CO2 vezivanje), 30 tRNA molekula i još 40 nepoznatih
proteini. Zanimljivo, sličan skup gena u DNK hloroplasta
nalazi u tako udaljenim predstavnicima višeg
biljke poput duhana i jetrene mahovine.
Najveći dio proteina kloroplasta kontrolira jezgra
genom. Pokazalo se da niz najvažnijih proteina, enzima,
i, shodno tome, metabolički procesi hloroplasta
su pod genetskom kontrolom jezgra. Da, mobilni
jezgro kontrolira pojedine faze sinteze hlorofila, karotenoida,
lipidi, skrob. Mnogi su pod nuklearnom kontrolom
enzimi tamne faze fotosinteze i drugi enzimi, u
uključujući neke komponente lanca transporta elektrona.
Nuklearni geni kodiraju DNK polimerazu i aminoacil-tRNA sintetazu
hloroplasti. Pod kontrolom nuklearnih gena postoji veliki
deo ribosomskih proteina. Svi ovi podaci tjeraju nas da pričamo
o hloroplastima, kao io mitohondrijama, kao strukturama
sa ograničenom autonomijom.
Prijenos proteina iz citoplazme u plastide se u principu odvija
slično kao i mitohondrije. I ovdje na mjestima konvergencije
Vanjska i unutrašnja membrana hloroplasta sadrže membrane koje formiraju kanale
integralni proteini koji prepoznaju signalne sekvence
proteini hloroplasta sintetizirani u citoplazmi i transport
ih u matriks-stromu. Proteini uvezeni iz strome prema
dodatne signalne sekvence mogu uključivati
u plastidne membrane (tilakoidi, stromalne lamele, vanjske
i unutarnje membrane) ili lokalizirana u stromi, ulazeći
u sastavu ribozoma, enzimskih kompleksa Calvinovog ciklusa i
itd.
Nevjerovatna sličnost strukture i energetskih procesa
u bakterijama i mitohondrijama, s jedne strane, iu plavo-zelenoj
alge i hloroplasti - s druge strane, služi kao uvjerljiv argument
u korist teorije o simbiotičkom porijeklu ovih organela.
Prema ovoj teoriji, pojava eukariotske ćelije
prošao kroz nekoliko faza simbioze sa drugim ćelijama.
U prvoj fazi, ćelije kao što su anaerobne heterotrofne bakterije
uključivale aerobne bakterije koje su se pretvorile u mitohondrije.
Paralelno s tim, u ćeliji domaćinu, prokariotski genofor
formira se u jezgro odvojeno od citoplazme. Tako da su mogli
nastaju heterotrofne eukariotske ćelije. Ponovljeno
endosimbiotski odnosi između primarnih eukariota
ćelije i plavo-zelene alge dovele su do pojave
sadrže strukture kao što su hloroplasti, koji omogućavaju ćelijama da rade
autosintetski procesi i ne zavise od prisustva organskih
podloge (sl. 236). U procesu postajanja takvog kompozita
živi sistem dio genetske informacije mitohondrija
a plastid bi se mogao promijeniti, premjestiti u jezgro. Na primjer
dvije trećine od 60 hloroplastnih ribosomskih proteina su kodirane
u jezgru i sintetiziraju se u citoplazmi, a zatim se inkorporiraju
u ribozome hloroplasta, koji imaju sva svojstva prokariota
ribozomi Ovo kretanje velikog dijela prokariota
gena u jezgro dovelo je do toga da ove stanične organele,
zadržavši dio svoje nekadašnje autonomije, došli su pod kontrolu ćelije
jezgro, koje u velikoj mjeri određuje sve glavne ćelijske
funkcije.
MOSKVA, 4. jula— RIA Novosti, Anna Urmantseva. Ko ima veći genom? Kao što znate, neka bića imaju složeniju strukturu od drugih, a budući da je sve zapisano u DNK, to bi trebalo da se odrazi iu njegovom kodu. Ispada da osoba sa svojim razvijenim govorom mora biti složenija od malog okruglog crva. Međutim, ako nas uporedite sa crvom po broju gena, dobijate otprilike isto: 20 hiljada gena Caenorhabditis elegans naspram 20-25 hiljada gena Homo sapiensa.
Još uvredljivija za “krunu zemaljskih stvorenja” i “kralja prirode” su poređenja sa pirinčem i kukuruzom – 50 hiljada gena u odnosu na 25 ljudi.
Međutim, možda pogrešno razmišljamo? Geni su "kutije" u koje su spakovani nukleotidi - "slova" genoma. Možda ih prebrojati? Ljudi imaju 3,2 milijarde parova nukleotida. Ali japansko vranje oko (Paris japonica) - prekrasna biljka s bijelim cvjetovima - ima 150 milijardi baznih parova u svom genomu. Ispada da bi osoba trebala biti 50 puta jednostavnija od nekog cvijeta.
Ispostavilo se da je protoptera plućne ribe (dupka - koja ima i škrge i plućno disanje) 40 puta složenija od ljudi. Možda su sve ribe nekako složenije od ljudi? br. Otrovna riba fugu, od koje Japanci pripremaju delikatesu, ima genom osam puta manji od ljudskog i 330 puta manji od genoma plućke Protoptera.
Ostaje samo prebrojati hromozome - ali ovo još više zbunjuje sliku. Kako osoba može biti jednaka po broju hromozoma jasenu, a čimpanza žoharu?

Evolucijski biolozi i genetičari su se davno susreli sa ovim paradoksima. Bili su primorani priznati da veličina genoma, bez obzira na to kako je pokušavamo izračunati, upadljivo nije povezana sa složenošću organizacije organizama. Ovaj paradoks je nazvan "misterija C-vrednosti", gde je C količina DNK u ćeliji (paradoks C-vrednosti, tačan prevod je "paradoks veličine genoma"). Pa ipak postoje neke korelacije između vrsta i kraljevstava.
© Ilustracija RIA Novosti. A. Polyanina

© Ilustracija RIA Novosti. A. Polyanina
Jasno je, na primjer, da eukarioti (živi organizmi čije ćelije sadrže jezgro) imaju u prosjeku veće genome od prokariota (živih organizama čije stanice ne sadrže jezgro). Kičmenjaci imaju, u prosjeku, veći genom od beskičmenjaka. Međutim, postoje izuzeci koje još niko nije uspeo da objasni.

Bilo je sugestija da je veličina genoma povezana s dužinom životnog ciklusa organizma. Koristeći biljke kao primjer, neki naučnici su tvrdili da višegodišnje vrste imaju veći genom od jednogodišnjih, obično s razlikom od nekoliko puta. A najmanji genomi pripadaju efemernim biljkama, koje prolaze kroz cijeli ciklus od rođenja do smrti u roku od nekoliko sedmica. Ovo pitanje se trenutno aktivno raspravlja u naučnim krugovima.
Objašnjava vodeći istraživač na Institutu za opštu genetiku. N.I. Vavilova sa Ruske akademije nauka, profesor Teksaškog agromehaničkog univerziteta i Univerziteta u Getingenu Konstantin Krutovski: „Veličina genoma nije povezana sa trajanjem životnog ciklusa organizma! Na primer, postoje vrste unutar isti rod koji imaju istu veličinu genoma, ali se mogu razlikovati u očekivanom životnom vijeku desetine, ako ne i stotine puta. Općenito, postoji veza između veličine genoma i evolucijskog napretka i složenosti organizacije, ali uz mnogo izuzetaka. Generalno, genom veličina je povezana s ploidnošću (broj kopija) genoma (a poliploidi se nalaze i u biljkama i životinjama) i količinom visoko repetitivne DNK (jednostavna i složena ponavljanja, transpozoni i drugi mobilni elementi).“

Postoje i naučnici koji imaju drugačije gledište po ovom pitanju.
Svi hromozomi i mitohondrijska DNK. Trenutno se ovi podaci aktivno koriste širom svijeta u biomedicinskim istraživanjima. Punim sekvenciranjem je otkriveno da ljudski genom sadrži 20-25 hiljada aktivnih gena, što je znatno manje od očekivanog na početku projekta (oko 100 hiljada) – odnosno samo 1,5% cjelokupnog genetskog materijala kodira proteine ili funkcionalnu RNK. Ostatak je nekodirajuća DNK, koja se često naziva junk DNK, ali za koju se pokazalo da igra važnu ulogu u regulaciji aktivnosti gena i oblikovanju cijelog organizma tokom razvoja.
Posebnosti
hromozomi
Genom sadrži 23 para hromozoma: 22 para autozomnih hromozoma, kao i par polnih hromozoma X i Y. Kod ljudi je muški pol heterogametan i određen je prisustvom Y hromozoma. Normalne diploidne somatske ćelije imaju 46 hromozoma.
Geni
Preliminarne procjene sugerirale su prisustvo više od 100 hiljada gena u ljudskom genomu. Prema rezultatima projekta Human Genome, broj gena, odnosno otvorenih okvira za čitanje, iznosio je oko 28.000 gena. U vezi sa unapređenjem metoda pretraživanja (predviđanja) gena, očekuje se dalje smanjenje broja gena.
Broj ljudskih gena nije mnogo veći od broja gena u jednostavnijim organizmima, na primjer, okrugli crv Caenorhabditis elegans ili muhe Drosophila melanogaster. To je zbog činjenice da je alternativno spajanje široko zastupljeno u ljudskom genomu. Alternativno spajanje vam omogućava da dobijete nekoliko različitih proteinskih lanaca iz jednog gena. Kao rezultat, ispada da je ljudski proteom znatno veći od proteoma razmatranih organizama. Većina ljudskih gena ima više egzona, a introni su često znatno duži od graničnih egzona u genu.
Geni su neravnomjerno raspoređeni po hromozomima. Svaki hromozom sadrži regije bogate i genom siromašne. Ovi regioni su u korelaciji sa hromozomskim zavojima (pruge preko hromozoma koje su vidljive pod mikroskopom) i sa regionima bogatim CG. Trenutno, značaj ove neravnomjerne raspodjele gena nije u potpunosti shvaćen.
Pored gena koji kodiraju proteine, ljudski genom sadrži hiljade RNK gena, uključujući transfer RNK (tRNA), ribosomalnu RNK, mikroRNA i druge sekvence RNK koje ne kodiraju proteine.
Drugi pristup za dobijanje regulatornih sekvenci zasniva se na poređenju ljudskih gena i gena ribe puhačice. Sekvence gena i regulatorne sekvence kod ljudi i fugu ribe su značajno slične, ali genom ribe fugu sadrži 8 puta manje količine „smeće DNK“. Ova "kompaktnost" genoma ribe čini mnogo lakšim traženje regulatornih sekvenci za gene. Drugi objekti u genomuSekvence kodiranja proteina (mnoge sekvence koje čine egzone) čine manje od 1,5% genoma. Bez uzimanja u obzir poznatih regulatornih sekvenci, ljudski genom sadrži mnogo objekata koji izgledaju kao nešto važno, ali čija je funkcija, ako postoji, trenutno nejasna. Zapravo, ovi objekti zauzimaju do 97% ukupnog volumena ljudskog genoma. Takvi objekti uključuju:
Prikazana klasifikacija nije iscrpna. Većinu predmeta svjetska naučna zajednica trenutno uopće nije klasificirala. Odgovarajuće sekvence su najvjerovatnije evolucijski artefakt. U modernoj verziji genoma, njihova funkcija je isključena, a te dijelove genoma mnogi nazivaju "smećem DNK". Međutim, postoji niz dokaza koji sugeriraju da ovi objekti imaju neku funkciju koja trenutno nije u potpunosti shvaćena. PseudogenesVirusiOko 1% ljudskog genoma zauzimaju integrirani geni retrovirusa (endogeni retrovirusi). Ovi geni obično ne koriste domaćinu, ali postoje izuzeci. Tako su prije oko 43 miliona godina retrovirusni geni koji su služili za izgradnju ljuske virusa ušli u genom predaka majmuna i čovjeka. Kod ljudi i majmuna ovi geni su uključeni u funkcionisanje placente. Većina retrovirusa integrirana je u genom ljudskih predaka prije više od 25 miliona godina. Do danas nisu pronađeni korisni endogeni retrovirusi među mlađim ljudskim endogenim retrovirusima. Informacijski sadržaj ljudskog genomavidi takođeBilješke
|
Genom ribe puferice je oko osam puta manji od ljudskog genoma i 330 puta manji od genoma plućne ribe Protoptera. Koji „duhovi“ žive na „genomskim grobljima“, a koliko smeća ima u našem DNK?
Poznati molekularni biolog David Penney iz Allen Wilson Centra za molekularnu ekologiju i evoluciju na novozelandskom Univerzitetu Massey jednom je rekao: „Bio bih prilično ponosan da sam bio dio grupe koja je razvila genom E. coli. Međutim, nikada ne bih priznao da sam učestvovao u dizajnu ljudskog genoma. Nijedan univerzitet nije mogao toliko upropastiti ovaj projekat.” Količina smeća u našoj DNK jedna je od najtoplijih tema u naučnoj zajednici. Među naučnicima se rasplamsavaju prave verbalne bitke oko ovog pitanja.
Malo molekularne genetike
Podsjetimo da je osnova za prijenos nasljednih informacija dvolančani DNK molekul. To je polimer četiri vrste monomera (nukleotida): adenina (A), timina (T), citozina (C) i guanina (G) - i raspoređen je u hromozome. Ljudi imaju 23 para hromozoma koji se nalaze u jezgru (22 para nespolnih hromozoma i jedan par polnih hromozoma). Oni čine osnovu našeg genoma (još 37 gena sadrži kružnu mitohondrijsku DNK). Kada bismo uzeli jednu ljudsku ćeliju, spojili cijeli diploidni (upareni) set hromozoma i razvukli ga u nit, dobili bismo molekul dug dva metra, koji se sastoji od šest milijardi baznih parova (nukleotida). Tri milijarde od tate i tri od mame.

Najviše proučavana vrsta funkcionalnih DNK sekvenci su geni koji kodiraju proteine. Iz takvih gena se očitava molekula RNK, koja zatim igra ulogu matrice za sintezu proteina i određuje njihov aminokiselinski slijed. Kodirajući dio RNA molekule može se podijeliti na triplete nukleotida (kodone), koji ili odgovaraju određenoj aminokiselini ili određuju krajnju tačku sinteze proteina (stop kodoni). Pravilo za slaganje kodona sa aminokiselinama naziva se genetski kod. Na primjer, GCC kodon kodira aminokiselinu alanin.
Hajde da uporedimo gene?
Nekada se smatralo da tako složen organizam kao što je osoba mora imati mnogo gena. Kada se projekat Ljudski genom bližio kraju, naučnici su čak vodili igru klađenja: koliko će gena biti otkriveno?
Zamislite njihovo iznenađenje kada se ispostavilo da je broj gena u osobi i mali okrugli crv Caenorhabditis elegans približno isto. Crv ima oko 20.000 gena, a mi 20-25 hiljada.
Za “krunu stvaranja” ova činjenica je prilično uvredljiva, posebno kada se uzme u obzir da postoji mnogo organizama sa oba veća genoma (genom plućke Protopterus, Protopterus aethiopicus, 40 puta više od ljudskog), i sa većim brojem gena (pirinač ima 32-50 hiljada gena).
Ali u stvarnosti, manje od 2% ljudskog genoma kodira bilo koji protein. Za šta je potrebno ostalih 98%? Možda tu leži tajna naše složenosti? Ispostavilo se da postoje važni nekodirajući regioni DNK. Na primjer, to su regije promotora - nukleotidne sekvence na kojima se nalazi enzim RNA polimeraza i odakle počinje sinteza RNA molekula. Ovo su vezna mjesta za faktore transkripcije - proteine koji reguliraju funkciju gena. To su telomeri, koji štite krajeve hromozoma, i centromere koje su neophodne za pravilno odvajanje hromozoma na različite polove ćelija tokom deobe. Poznati su neki regulatorni RNA molekuli (na primjer, mikroRNA koje sprječavaju sintezu proteina odgovarajućih gena na glasničkoj RNK - kopiji izvornog gena), kao i molekule RNK koje su dio važnih enzimskih kompleksa - na primjer ribozomi , koji sastavljaju proteine iz pojedinačnih aminokiselina, krećući se duž glasničke RNK. Postoje i drugi primjeri važnih nekodirajućih regija DNK.
Međutim, većina našeg genoma liči na pustinju: ponavljajuće sekvence, ostaci “mrtvih” virusa koji su davno ugrađeni u genome naših predaka; takozvani sebični mobilni elementi - DNK sekvence koje mogu skočiti s jednog dijela genoma na drugi; razni pseudogeni – nukleotidne sekvence koje su izgubile sposobnost kodiranja proteina kao rezultat mutacija, ali su ipak zadržale neke od karakteristika gena. Ovo nije potpuna lista “duhova” koji žive na “genomskom groblju”.
Minimalni miš
Postoji stajalište da je većina ljudskog genoma nefunkcionalna. 2004. časopis Priroda objavio članak koji opisuje miševe iz čijeg genoma su izrezani značajni fragmenti nekodirajuće DNK veličine 0,8 pa čak i 1,5 miliona nukleotida. Pokazalo se da se ovi miševi ne razlikuju od običnih miševa po građi tijela, razvoju, očekivanom životnom vijeku ili sposobnosti ostavljanja potomstva. Naravno, neke razlike su mogle proći nezapaženo, ali sve u svemu, ovo je bio ozbiljan argument u prilog postojanju “junk DNK”, kojeg se može riješiti bez posebnih posljedica. Naravno, bilo bi zanimljivo izrezati ne par miliona nukleotida, već milijardu, ostavljajući samo predviđene sekvence gena i poznate funkcionalne elemente. Hoće li biti moguće razviti takvog "minimalnog miša" i hoće li on moći normalno postojati? Može li se čovjek snaći sa genomom dugim samo pola metra? Možda ćemo jednog dana saznati za ovo. U međuvremenu, još jedan važan argument u prilog postojanja junk DNK je prisustvo prilično bliskih organizama s vrlo različitim veličinama genoma.
Genom ribe puferice je oko osam puta manji od ljudskog genoma (iako ima otprilike isti broj gena), a 330 puta manji od genoma već spomenute ribe Protoptera. Ako bi svaki nukleotid u genomu bio funkcionalan, onda je nejasno zašto bi luku trebao genom pet puta veći od našeg?
Evolucijski biolog Susumu Ono skrenuo je pažnju na kolosalne razlike u veličinama genoma sličnih organizama. Vjeruje se da je Ono skovao izraz „smeća DNK“. Davne 1972. godine, mnogo prije nego što je ljudski genom pročitan, Ono je izrazio uvjerljive ideje i o broju gena u ljudskom genomu i o količini "smeća" u njemu. U svom članku “Toliko smeće DNK u našem genomu” on napominje da u ljudskom genomu mora postojati oko 30.000 gena. Ovaj broj, koji tada nije bio nimalo očigledan, pokazao se iznenađujuće blizak stvarnom, za šta se saznalo decenijama kasnije. Osim toga, Ono daje procjenu funkcionalne frakcije genoma (6%), proglašavajući više od 90% ljudskog genoma otpadom.
specijalista za evolucijsku biologiju i integrativnu genomiku, vanredni profesor na kanadskom univerzitetu Guelph u Ontariju:“Test s lukom je dobar test za svakoga ko misli da svaki nukleotid u ljudskom genomu ima određenu funkciju. Bez obzira na to koje su ove navodne funkcije, zapitajte se: Zašto tipičnom luku treba genom oko pet puta veći od vašeg?
Pronađi ili odložiš?
Ideju o postojanju junk DNK osporio je projekat ENCODE - Encyclopedia of DNK Elements (njegovi prvi rezultati objavljeni su u časopisu Priroda 2012. godine). Dobivši brojne eksperimentalne podatke o tome koji dijelovi ljudskog genoma stupaju u interakciju s različitim proteinima, uključeni su u transkripciju - sintezu RNK kopija gena za naknadnu translaciju (sinteza proteina iz aminokiselina na matrici RNK za prijenos podataka) - ili druge biokemijske procese, autori su došli do zaključka da je više od 80% ljudskog genoma funkcionalno na ovaj ili onaj način. Naravno, ova teza je izazvala burnu diskusiju u naučnoj zajednici.
Jedan od ironičnijih članaka objavio je Dan Graur, molekularni evolucijski bioinformatičar i profesor na Univerzitetu u Hjustonu, i njegove kolege 2013. godine u časopisu Biologija i evolucija genoma, naziva se: „O besmrtnosti televizora: „funkcionisanje“ u ljudskom genomu prema evanđelju bez evolucije iz ENCODE-a.” Njegovi autori napominju da se pojedini članovi konzorcijuma ENCODE ne slažu oko toga koliko je genoma funkcionalno. Tako je jedan od njih ubrzo razjasnio u časopisu Genomicron da ne govorimo o 80% funkcionalnih sekvenci u genomu, već o 40%, već o drugom (u članku u Scientific American) i potpuno smanjio brojku na 20%, ali je u isto vrijeme nastavio insistirati da se termin „junk DNK“ eliminira iz leksikona.
Prema autorima članka “O besmrtnosti televizija”, članovi konzorcijuma ENCODE suviše slobodno tumače pojam “funkcija”. Na primjer, postoje proteini koji se nazivaju histoni. Oni mogu vezati molekulu DNK i pomoći joj da se kompaktno savije. Histoni mogu biti podvrgnuti određenim hemijskim modifikacijama. Prema ENCODE-u, pretpostavljena funkcija jedne od ovih histonskih modifikacija je da "radije bude na 5" kraju gena (kraj 5" je kraj gena iz kojeg se kreću enzimi DNK i RNA polimeraze prilikom kopiranja DNK ili tokom transkripcija). „Na sličan način, moglo bi se reći da je funkcija Bijele kuće da zauzme prostor na 1600 Pennsylvania Avenue, Washington, D.C.“, primjećuju protivnici.
Postoji i problem sa dodjeljivanjem funkcija dijelovima DNK. Pretpostavimo da je protein važan za funkcionisanje ćelije sposoban da se veže za određeni deo DNK, i stoga ENCODE ovom delu dodeljuje „funkciju“. Na primjer, određeni faktor transkripcije - protein koji inicira sintezu glasničke RNK - vezuje se za sljedeću sekvencu nukleotida: TATAAA. Razmotrite dvije identične TATAAA sekvence u različitim dijelovima genoma. Nakon što se faktor transkripcije veže za prvu sekvencu, počinje sinteza molekule RNK, koja služi kao šablon za sintezu drugog važnog proteina. Mutacije (supstitucije bilo kojeg od nukleotida) u ovoj sekvenci će uzrokovati da se RNK loše čita, protein se neće sintetizirati, a to će najvjerovatnije negativno utjecati na opstanak organizma. Stoga će se ispravna TATAAA sekvenca održati na datoj lokaciji u genomu prirodnom selekcijom, u kom slučaju je prikladno govoriti o njenoj funkciji.
Još jedna TATAAA sekvenca nastala je u genomu iz nasumičnih razloga. Pošto je identičan prvom, za njega se vezuje i faktor transkripcije. Ali u blizini nema gena, tako da vezivanje ne vodi ničemu. Ako dođe do mutacije na ovom području, ništa se neće promijeniti i tijelo neće patiti. U ovom slučaju, nema smisla govoriti o funkciji drugog dijela TATAAA. Međutim, može se ispostaviti da je prisustvo velikog broja TATAAA sekvenci u genomu daleko od gena jednostavno neophodno da bi se vezao faktor transkripcije i smanjila njegova efektivna koncentracija. U ovom slučaju, selekcija će regulisati broj takvih sekvenci u genomu.
Da bi se dokazalo da je određeni dio DNK funkcionalan, nije dovoljno pokazati da se neki biološki proces (na primjer, vezivanje DNK) odvija u tom području. Članovi konzorcijuma ENCODE pišu da funkciju posjeduju dijelovi DNK koji su uključeni u transkripciju. “Ali zašto je potrebno fokusirati se na činjenicu da je 74,7% genoma transkribovano, dok možemo reći da 100% genoma učestvuje u reproducibilnom biohemijskom procesu – replikaciji!”, opet se šali Graur.
Replikacija
Replikacija (od latinskog replicatio - obnavljanje) je proces sinteze kćerke molekule deoksiribonukleinske kiseline na matičnom matriksu. Tokom sljedeće diobe, svaka od ćelija kćeri dobija po jednu kopiju molekula DNK identične DNK originalne matične ćelije. Replikaciju DNK provodi replizom, složeni enzimski kompleks koji se sastoji od 15-20 različitih proteina.
Dobar kriterijum za funkcionalnost regiona DNK je da su mutacije u njemu prilično štetne i da se značajne promene u ovoj regiji ne primećuju iz generacije u generaciju. Kako prepoznati takva područja? Tu u pomoć priskače bioinformatika, moderna nauka na raskrsnici biologije i matematike o analizi genskih i proteinskih sekvenci. Možemo uzeti genom čovjeka i miša i pronaći sve slične dijelove DNK u njima. Ispostavilo se da su kod ove dvije vrste neki dijelovi nukleotidnih sekvenci vrlo slični. Na primjer, geni potrebni za sintezu ribosomskih proteina su prilično konzervativni, odnosno mutacije u njima su dovoljno štetne da nosioci novih mutacija umiru bez ostavljanja potomstva. Za takve se gene kaže da su pod negativnom selekcijom, što ih čisti od štetnih mutacija. Drugi regioni genoma će imati značajne divergencije između vrsta, što ukazuje da su mutacije u ovim regionima verovatno bezopasne, pa je stoga njihova funkcionalna uloga mala ili nije određena specifičnom sekvencom nukleotida. Brojne studije su procijenile udio područja ljudske DNK pod negativnim pritiskom selekcije. Pokazalo se da im pripada samo oko 6,5-10% genoma, a nekodirajuća područja, za razliku od kodirajućih, mnogo su manje podložna negativnoj selekciji. Ispostavilo se da je, sa stanovišta evolucijskih kriterija, manje od 10% ljudskog genoma funkcionalno. Obratite pažnju koliko je Ono bio blizu ovoj proceni 1972. godine!
Garbage fortress


Ali da li je preostalih 90% ljudskog genoma zaista smeće kojega je bolje ukloniti? Ne sigurno na taj način. Postoje razmatranja da velika veličina genoma može sama po sebi biti korisna. U bakterijama, replikacija genoma je ozbiljan ograničavajući faktor koji zahtijeva značajnu potrošnju energije. Stoga su njihovi genomi obično mali, a oni se riješe svega nepotrebnog. U velikim organizmima, u pravilu, replikacija DNK stanica koje se dijele ne daje tako veliki doprinos ukupnoj količini potrošnje energije tijela na pozadini troškova za funkcioniranje mozga, mišića, organa za izlučivanje, održavanje tjelesne temperature. , itd. Istovremeno, veliki genom može biti važan izvor genetske raznolikosti, povećavajući šanse za nastanak novih funkcionalnih regija iz nefunkcionalnih zbog mutacija koje su potencijalno korisne u procesu evolucije. Prenosivi elementi mogu prenijeti regulatorne elemente, stvarajući genetsku raznolikost u regulaciji funkcije gena. Odnosno, organizmi sa velikim genomima se teoretski mogu brže prilagoditi uslovima okoline, plaćajući relativno male dodatne troškove za replikaciju većeg genoma. Ovaj efekat nećemo pronaći u pojedinačnom organizmu, ali on može igrati važnu ulogu na nivou populacije.
Posjedovanje velikog genoma također može smanjiti vjerovatnoću da će se virus ubaciti u funkcionalni gen (što može dovesti do neuspjeha gena i, u nekim slučajevima, raka). Drugim riječima, moguće je da prirodna selekcija može djelovati ne samo na održavanje specifičnih sekvenci u genomu, već i na očuvanje određenih veličina genoma, sastava nukleotida u nekim njegovim regijama, itd.
Međutim, iako je ideja da je samo 80% ili čak 20% ljudskog genoma funkcionalno kontroverzna, to ne znači da je cijeli ENCODE projekat podložan kritici. U okviru njega dobijena je ogromna količina podataka o tome kako se različiti proteini vezuju za DNK, informacija o regulaciji gena itd. Ovi podaci su od velikog interesa za specijaliste. Ali malo je vjerovatno da će se u bliskoj budućnosti moći riješiti "smeća" u genomu - i koncepta i samih nepotrebnih sekvenci.
Članak za konkurs "bio/mol/tekst": Ovo je zanimljivo pitanje na koje je trebalo da odgovori projekat Ljudski genom, koji je završen 2003. godine. Nakon što su naučnici dobili osnovne informacije o ljudskom genomu, pokušali su da odrede broj gena, ali taj zadatak nije bio tako jednostavan. Svrha ovog članka je sažeti i analizirati naučne podatke o sastavljanju kataloga ljudskih gena.
Generalni pokrovitelj takmičenja je kompanija Diaem: najveći dobavljač opreme, reagensa i potrošnog materijala za biološka istraživanja i proizvodnju.

Pokrovitelj nagrade publike je Medicinsko genetički centar.

"Knjiga" pokrovitelj takmičenja - "Alpina Non-fiction"
Kako se malo zna o genima! Prvi put sam to akutno osjetio dok sam vježbao u laboratoriji medicinske genetike na Harbinskom medicinskom univerzitetu. Istraživačka grupa u kojoj sam internirala proučavala je onkogen Sei-1, koji indukuje formiranje dvominutnih hromozoma (DM), što doprinosi razvoju onkogeneze. Međutim, mehanizam formiranja onkogena Sei-1 do danas je nepoznat. Ali razne mutacije gena uzrok su i drugih opasnih ljudskih bolesti, osim raka. Dakle, u ovom članku ćemo iznijeti neka razmišljanja o tome zašto još uvijek ne znamo mnogo o genima, a također ćemo formulirati svoje mišljenje o tome koliko gena osoba ima.
Projekat ljudskog genoma i kompletna lista gena
Identifikacija kompletne liste gena neophodna je da bi se razjasnili molekularni mehanizmi nastanka i razvoja raka, šizofrenije, demencije i mnogih drugih ljudskih bolesti. Sekvenciranje DNK izolovane iz tkiva pacijenata omogućava identifikaciju mutacija kao što su nukleotidne supstitucije, delecije i insercije odgovorne za pojavu ovih bolesti.
Zapravo, zbog toga je i pokrenut Projekat Ljudskog genoma ( Projekat ljudskog genoma, HGP), koji je trajao od 1990. do 2003. godine. Njegov glavni zadatak bio je da odredi nukleotidnu sekvencu ljudske DNK i lokaciju 100.000 ljudskih gena (kako se tada vjerovalo). Paralelno, planirano je proučavanje DNK skupa modelnih organizama kako bi se dobile uporedne informacije neophodne za razumijevanje funkcioniranja ljudskog genoma. Namjera je bila da informacije dobijene kao rezultat HGP-a postanu referentna knjiga za biomedicinsku nauku u 21. vijeku. Ciljevi ovih studija bili su da se dobiju informacije o uzrocima niza bolesti i, konačno, da se razviju tretmani za više od 4.000 genetskih bolesti koje pogađaju čovječanstvo, uključujući multifaktorske bolesti u kojima genetska osjetljivost igra važnu ulogu. Vjerovalo se da će nam rezultati sekvenciranja genoma omogućiti da odredimo lokaciju svakog gena i njihov ukupan broj. Međutim, kasniji događaji su pokazali suprotno: danas postoji nekoliko baza podataka gena koje se međusobno značajno razlikuju. Štoviše, broj gena koji kodiraju proteine se poklapa, ali se broj gena drugih tipova razlikuje.
Human Proteome Project
2010. godine, na inicijativu Organizacije za proučavanje ljudskog proteoma ( Ljudska proteomska organizacija, HUPO) započet je projekat “Human Proteome” ( HE), koji ima za cilj stvaranje kompletne liste proteina vrste Homo sapiens. Da bi se to postiglo, prvo se pretpostavlja da se identifikuje i okarakteriše najmanje jedan proteinski proizvod gena koji kodiraju proteine, njihovi jednonukleotidni polimorfizmi i varijante spajanja, kao i vrste posttranslacionih modifikacija proteina. Drugo, proteomski podaci dobijeni kao rezultat implementacije HPP doprinose, pored genomskih podataka, rješavanju raznih biomedicinskih problema i stvaranju novih anotiranih baza znanja, kao npr. neXtProt .
Trenutno neXtProt sadrži informacije o 17.487 proteina čije je postojanje eksperimentalno potvrđeno, 1.728 proteina potvrđeno na nivou transkripta, 515 identificiranih na osnovu homologije, 76 predviđenih i 571 nepoznate prirode. Od posebnog interesa su proteini čije postojanje nije eksperimentalno dokazano, iako postoje dokazi da ih kodira genom. To su takozvani "izgubljeni" proteini, koji čine približno 18% svih kodiranih proteina. Stvoren je resurs za identifikaciju i karakterizaciju takvih proteina MissingProteinPedia .
Ljudski proteom je nastavak projekta Ljudski genom. Očekuje se da ćemo zahvaljujući projektu istraživanja proteoma saznati tačan broj gena koji kodiraju proteine, što će nam naknadno omogućiti da shvatimo koliko gena osoba ima.
Malo o RNK
Projekat Human Genome je pokazao da su molekule RNK važne za život kao i DNK. Postoji mnogo RNK unutar ćelija (slika 2). U početku se RNK dijeli na nekodirajuće RNA (ncRNA), koji se ne prevode u proteine, i kodiranje RNK (mRNA), koji služi kao matrica za sintezu proteinskih polipeptidnih lanaca. Nekodirajuće RNK imaju složeniju klasifikaciju. Oni su infrastrukturni i regulatorni. Infrastrukturne RNA predstavljaju ribosomalnu RNK (rRNA) i transfernu RNK (tRNA). rRNA molekule se sintetiziraju u nukleolu i čine osnovu ribozoma, a također kodiraju proteine ribosomskih podjedinica. Kada se rRNK u potpunosti sastave, one se kreću u citoplazmu, gdje, kao ključni regulatori translacije, učestvuju u čitanju mRNA koda. Sekvenca tri azotne baze u mRNA ukazuje na uključivanje specifične aminokiseline u sekvencu proteina. tRNA molekule dovode ove aminokiseline do ribozoma, gdje se sintetizira protein.
Više o RNK pročitajte u člancima “Biomolekule”: “ O svim RNK na svijetu, velikim i malim», « Kodiranje nekodirajuće RNK" i " Moć prstenova: Svemoćne kružne RNK» .

Slika 2. RNK vrste
Regulatorne ncRNA su veoma široko zastupljene u organizmu, klasifikovane su u zavisnosti od veličine i obavljaju niz važnih funkcija (tabela 1).
| Ime | Oznaka | Dužina | Funkcije | |
|---|---|---|---|---|
| Duge nekodirajuće RNK | lncRNA, lncRNA | 200 nukleotida | 1. Regulirajte selektivnu metilaciju DNK usmjeravanjem DNK metiltransferaze 2. Usmjeravaju selektivnu sadnju represorskih kompleksa polycomb |
|
| Male RNK | Male nuklearne RNK | snRNA, snRNA | 150 nukleotida | 1. Učestvujte u spajanju 2. Regulisati aktivnost transkripcionih faktora 3. Održavajte integritet telomera |
| Male nukleolarne RNK | snoRNA, snoRNA | 60–300 nukleotida | 1. Učestvujte u hemijskoj modifikaciji rRNA, tRNK i snRNK 2. Moguće uključenje u stabilizaciju strukture rRNA i zaštitu od djelovanja hidrolaza |
|
| Mala interferirajuća RNK | miRNA, siRNA | 21–22 nukleotida | 1. Osigurati antivirusnu imunološku zaštitu 2. Potisnuti aktivnost vlastitih gena |
|
| Mikro RNA | miRNA, miRNA | 18–25 nukleotida | Suzbijanje translacije RNA interferencijom | |
| Antisense RNA | asRNA | 1. Kratki: manje od 200 nukleotida 2. Dugačak: više od 200 nukleotida |
Blokirajte translaciju formiranjem hibrida sa mRNA | |
| RNK povezane s Piwi proteinima | piRNA, piwiRNA | 26–32 nukleotida | Nazivaju ih i „čuvari genoma“, potiskuju aktivnost mobilnih genetskih elemenata tokom embriogeneze | |
Terminološki problem
Prije nego što odgovorite na pitanje: "Koliko gena imamo?", morate razumjeti šta je gen?
Glavni fokus HGP-a bio je na genima koji kodiraju proteine. Međutim, kako je navedeno u originalnom izvještaju HGP-a iz 2001. godine, " hiljade ljudskih gena proizvode nekodirajuće RNK (ncRNA), koje su njihovi krajnji proizvodi“, iako je u to vrijeme bilo poznato oko 706 ncRNA gena. U nedavno objavljenom članku u časopisu BMC Biology Stephen Salzberg ( Steven L. Salzberg) daje sljedeću definiciju gena:
Gen je bilo koji dio hromozomske DNK koji se prepisuje u funkcionalnu molekulu RNK ili se prvo transkribira u RNK, a zatim se prevodi u funkcionalni protein.
Ova definicija uključuje i nekodirajuće RNA gene i gene koji kodiraju proteine i dozvoljava da se sve alternativne varijante spajanja na jednom lokusu definiraju kao varijante istog gena. Ovo vam omogućava da isključite pseudogenes– nefunkcionalni ostaci strukturnih gena koji su izgubili sposobnost kodiranja proteina.
Rezultati prve dvije studije ukazali su na prisustvo 31.000 i 26.588 gena koji kodiraju proteine kod ljudi, a 2004. godine pojavila se kompletna sekvenca ljudskog genoma, a autori su procijenili da kompletan katalog sadrži 24.000 gena koji kodiraju proteine. Katalog ljudskih gena Ensembl uključuje 22.287 gena koji kodiraju proteine i 34.214 transkripata.
Sekvenciranje sljedeće generacije (NGS)
Pojava visokopropusnih metoda paralelno sekvenciranje(u ovoj vrsti sekvenciranja, milioni fragmenata DNK iz jednog uzorka se sekvenciraju istovremeno) ili sekvenciranje sljedeće generacije (sekvenciranje nove generacije, NGS) omogućilo je značajno ubrzanje traženja funkcionalnih regija genoma. Biotehnološke kompanije razvile su i komercijalizirale različite platforme za NG sekvenciranje koje mogu sekvencirati od milion do desetina milijardi kratkih sekvenci (čita, čita) svaki dug 50-600 nukleotida. Najpopularnije platforme uključuju: Illumina I IonTorrent, korištenjem DNK amplifikacije PCR-om, kao i platforme za sekvencioniranje jedne molekule kao što su Helicos Biosciences HeliScope, Pacific Biosciences SMRT (sekvenciranje jednog molekula u realnom vremenu), i sekvenciranje nanopora Oxford Nanopore, koji vrše sekvenciranje u realnom vremenu i omogućavaju očitavanje znatno dužih očitavanja - do 10–60 hiljada nukleotida. Pored toga, pronalazak sekvenciranja RNK ( RNA-seq) 2008. godine, koji je kreiran da kvantifikuje ekspresiju gena, takođe je doprineo otkrivanju transkribovanih sekvenci, kako kodirajućih tako i nekodirajućih RNK.
Zahvaljujući NGS-u, baze podataka lncRNA i drugih RNK gena (kao što su mikroRNA) su dramatično porasle tokom decenije, a trenutni katalozi ljudskih gena sada sadrže više gena koji kodiraju RNK nego gena koji kodiraju proteine (Tabela 2).
| Vrste gena | Gencode | Ensembl | RefSeq | CHESS |
|---|---|---|---|---|
| Geni koji kodiraju proteine | 19 901 | 20 376 | 20 345 | 21 306 |
| Dugi nekodirajući RNA geni | 15 779 | 14 720 | 17 712 | 18 484 |
| Antisense RNA | 5501 | - | 28 | 2694 |
| Druge nekodirajuće RNK | 2213 | 2222 | 13 899 | 4347 |
| Pseudogenes | 14 723 | 1740 | 15 952 | - |
| Ukupan broj transkripata | 203 835 | 203 903 | 154 484 | 323 827 |
RNK sekvenciranje je otkrilo da se alternativno spajanje, alternativno inicijacija transkripcije i alternativna terminacija transkripcije javljaju mnogo češće nego što se mislilo, utičući na do 95% ljudskih gena. Stoga, čak i ako je lokacija svih gena poznata, sve izoforme tih gena moraju se prvo identificirati i da li te izoforme imaju bilo kakvu funkciju ili jednostavno predstavljaju greške spajanja.
Baza podataka ljudskih gena
Zadatak sastavljanja kataloga svih gena još uvijek nije riješen. Problem je što su u posljednjih 15 godina samo dvije istraživačke grupe sastavile listu dominantnih gena: RefSeq , koju podržava Nacionalni centar za biotehnološke informacije ( NCBI) u Nacionalnom institutu za zdravlje ( NIH), I Ensembl/Gencode , koji je podržan od strane Evropske laboratorije za molekularnu biologiju ( EMBL). Međutim, uprkos velikom napretku, sada broj gena koji kodiraju proteine, dugih nekodirajućih RNK gena, pseudogena u katalozima varira, a varira i broj antisens RNK i drugih nekodirajućih RNK (Tabela 2). Katalozi se još dovršavaju: u protekloj godini, na primjer, stotine gena koji kodiraju protein su dodani ili uklonjeni sa liste Gencode. Ova neslaganja objašnjavaju problem stvaranja kompletnog kataloga ljudskih gena.
2017. godine kreirana je nova baza podataka ljudskih gena - CHESS . Značajno, uključuje sve gene koji kodiraju proteine kao što su Gencode, dakle RefSeq, dakle korisnici CHESS nema potrebe da odlučujete koju bazu podataka preferiraju. Više gena može uzrokovati više grešaka, ali kreatori vjeruju da će veći skup biti koristan u proučavanju ljudskih bolesti koje još nisu klasificirane kao genetske. Gene set CHESS Trenutno u verziji 2.0 još nije konačan, a kreatori sigurno rade na poboljšanju.