يصف هذا القسم الخصائص الوراثية للكائنات الحية المختلفة.
معلومات عامة
مع المفارقة- طول الجينوم لا يعتمد على مدى تعقيد الكائن الحي.
أحجام الجينوم المقارنة في مجموعات مختلفة من الكائنات الحية.
| شيء | حجم الجينوم، بي بي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الميكوبلازما | 10 4 -10 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| يوباكتيريا (الإشريكية القولونية) | 10 5 -10 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الفطر | (2-5)×10 7 |
| منظر | عدد الجينات | طول الجينوم، بي بي |
| يوباكتيريا | ||
| الميكوبلازما التناسلية | 477 | 580.070 |
| Synechocystis sp. | 3168 | 3573 الف |
| بكتريا قولونية | 4280 | 4.639.221 |
| هيليكوباكتر بيلوري | 1590 | 1667 الف |
| العصوية الرقيقة | 4099 | 4214 الف |
| اكويفكس ايوليكوس | 1544 | 1551 الف |
| السل الفطري | 4402 | 4447 الف |
| اللولبية الشاحبة | 1041 | 1138 الف |
| الريكتسيا بروازيكي | 834 | 1111 الف |
| ثيرموتوغا ماريتيما | 1877 | 1860 الف |
| العتيقة | ||
| ميثانوكوككوس ساناشي | 1750 | 1664 الف |
| أركيوجلوبوس فولجيدوس | 2493 | 2178 الف |
| ايروبيروم بيرنيكس | 2620 | 669 الف |
| حقيقيات النوى | ||
| خميرة الخمر | ~6300 | 12.069 ألف |
| نبات الأرابيدوبسيس thaliana | ~26000 | 142.000 ألف |
| أنواع معينة انيقة | ~19000 | 97.000 ألف |
| ذبابة الفاكهة سوداء البطن | ~14000 | 137.000 ألف |
| X.laevis | ||
| الإنسان العاقل | ~30000 | 3.200.000 الف |
الجينوم حقيقي النواة
الجينات البشرية
لدى البشر 23 زوجًا من الكروموسومات، 22 كروموسومًا جسميًا وزوجًا واحدًا من الكروموسومات الجنسية XX (أنثى) أو XY (ذكر).
يتضمن الجينوم البشري أحادي الصيغة الصبغية أكثر من 3 مليارات زوج من قواعد الحمض النووي، ويبلغ طولها الإجمالي حوالي 1.8 متر، ويشغل إجمالي كمية المعلومات المسجلة في الحمض النووي البشري حوالي 750 ميغابايت.
يحتوي الجينوم البشري أحادي الصيغة الصبغية على ما يقرب من 20.000 إلى 25.000 جينة لترميز البروتين.
حوالي 1.5% من الجينوم عبارة عن بروتين مشفر، بينما يتضمن باقي الحمض النووي تسلسلات تنظيمية، وإنترونات، وتسلسلات تشفير RNA، وتكرارات مختلفة، وما إلى ذلك.
يتكون حوالي 8% من الجينوم من تسلسلات معطلة من الفيروسات القهقرية HERV (الفيروس القهقري البشري الداخلي)، وأصغرها، HERV-K، يبلغ عمره حوالي 5 ملايين سنة.
أعاد باحثون فرنسيون بناء تسلسل أحد الفيروسات القهقرية لعائلة HERV-K الموجودة في الجينوم. في خلايا الخط 239T، حدث نسخ الحمض النووي الفيروسي وإنتاج الجزيئات الفيروسية. علاوة على ذلك، تبين أن الفيروس نفسه، المسمى فينيكس، قادر بشكل مستقل على تنفيذ الدورة الكاملة للفيروسات القهقرية بدءًا من عدوى الخلايا وحتى الاندماج في الجينوم وتجميع الجزيئات الفيروسية. بعض الأورام، مثل سرطان المسخ والورم الميلانيني، تعبر عن بروتينات HERV متميزة. وهذا لا يكفي لتجميع فيروس كامل، فهناك عدد كبير جدًا من الطفرات. ومع ذلك، فإن "قيامة" الفيروس الكامل قد تحدث بسبب إعادة التركيب التلقائي - وقد تم تأكيد الاحتمال الأساسي لذلك من خلال نتائج العلماء الفرنسيين.
| كروموسوم | جينوف | الطول، مون | متسلسل |
| 1 | 3,148 | 247,200,000 | 224,999,719 |
| 2 | 902 | 242,750,000 | 237,712,649 |
| 3 | 1,436 | 199,450,000 | 194,704,827 |
| 4 | 453 | 191,260,000 | 187,297,063 |
| 5 | 609 | 180,840,000 | 177,702,766 |
| 6 | 1,585 | 170,900,000 | 167,273,992 |
| 7 | 1,824 | 158,820,000 | 154,952,424 |
| 8 | 781 | 146,270,000 | 142,612,826 |
| 9 | 1,229 | 140,440,000 | 120,312,298 |
| 10 | 1,312 | 135,370,000 | 131,624,737 |
| 11 | 405 | 134,450,000 | 131,130,853 |
| 12 | 1,330 | 132,290,000 | 130,303,534 |
| 13 | 623 | 114,130,000 | 95,559,980 |
| 14 | 886 | 106,360,000 | 88,290,585 |
| 15 | 676 | 100,340,000 | 81,341,915 |
| 16 | 898 | 88,820,000 | 78,884,754 |
| 17 | 1,367 | 78,650,000 | 77,800,220 |
| 18 | 365 | 76,120,000 | 74,656,155 |
| 19 | 1,553 | 63,810,000 | 55,785,651 |
| 20 | 816 | 62,440,000 | 59,505,254 |
| 21 | 446 | 46,940,000 | 34,171,998 |
| 22 | 595 | 49,530,000 | 34,893,953 |
| X | 1,093 | 154,910,000 | 151,058,754 |
| ي | 125 | 57,740,000 | 22,429,293 |
جينوم الشمبانزي
جينوم ذبابة الفاكهة
جينوم النيماتودا
جينوم الميتوكوندريا
يتم تمثيل الحمض النووي في الميتوكوندريا بجزيئات حلقية لا تشكل روابط مع الهستونات، فهي تشبه في هذا الصدد الكروموسومات البكتيرية.
في البشر، يحتوي الحمض النووي للميتوكوندريا على 16.5 ألف نقطة أساس، وقد تم فك شفرته بالكامل. وقد وجد أن الحمض النووي للميتوكوندريا لمختلف الكائنات متجانس للغاية، والفرق بينهما يكمن فقط في حجم الإنترونات والمناطق غير المكتوبة. يتم تمثيل جميع الحمض النووي للميتوكوندريا بنسخ متعددة، يتم جمعها في مجموعات أو مجموعات. وبالتالي، يمكن أن تحتوي ميتوكوندريا كبد الفئران الواحدة على من 1 إلى 50 جزيء DNA دوري. يبلغ إجمالي كمية الحمض النووي للميتوكوندريا لكل خلية حوالي واحد بالمائة. لا يرتبط تخليق الحمض النووي للميتوكوندريا بتخليق الحمض النووي في النواة. تمامًا كما هو الحال في البكتيريا، يتم جمع الحمض النووي للميتوكوندريا في منطقة منفصلة - النواة، ويبلغ قطرها حوالي 0.4 ميكرون. يمكن أن تحتوي الميتوكوندريا الطويلة على من 1 إلى 10 نويات. عندما تنقسم ميتوكوندريا طويلة، يتم فصل الجزء الذي يحتوي على النواة عنها (على غرار الانشطار الثنائي للبكتيريا). يمكن أن تتقلب كمية الحمض النووي في نواة الميتوكوندريا الفردية بما يصل إلى 10 أضعاف اعتمادًا على نوع الخلية. عندما تندمج الميتوكوندريا، يمكن تبادل مكوناتها الداخلية.
يختلف الرنا الريباسي (rRNA) والريبوسومات في الميتوكوندريا بشكل حاد عن تلك الموجودة في السيتوبلازم. إذا تم العثور على ريبوسومات 80s في السيتوبلازم، فإن ريبوسومات الميتوكوندريا في الخلايا النباتية تنتمي إلى ريبوسومات 70s (تتكون من وحدات فرعية 30s و 50s، وتحتوي على 16s و 23s RNA، وهي خاصية الخلايا بدائية النواة)، وتم العثور على ريبوسومات أصغر (حوالي 50s) في السيتوبلازم. الميتوكوندريا في الخلايا الحيوانية. في الميتوبلازم، يحدث تخليق البروتين على الريبوسومات. ويتوقف، على عكس التوليف على الريبوسومات السيتوبلازمية، تحت تأثير المضاد الحيوي الكلورامفينيكول، الذي يثبط تخليق البروتين في البكتيريا.
يتم تصنيع RNAs الناقل أيضًا على جينوم الميتوكوندريا، حيث يتم تصنيع إجمالي 22 RNAs. يختلف الكود الثلاثي للنظام الاصطناعي للميتوكوندريا عن ذلك المستخدم في الهيالوبلازم. على الرغم من وجود جميع المكونات الضرورية لتخليق البروتين، إلا أن جزيئات الحمض النووي الصغيرة للميتوكوندريا لا يمكنها تشفير جميع بروتينات الميتوكوندريا، فقط جزء صغير منها. إذن يبلغ حجم الحمض النووي 15 ألف نقطة أساس. يمكنه تشفير البروتينات بوزن جزيئي إجمالي يبلغ حوالي 6x105. في الوقت نفسه، يصل الوزن الجزيئي الإجمالي لبروتينات جسيم المجموعة التنفسية الكاملة للميتوكوندريا إلى حوالي 2x106.
أرز. الأحجام النسبية للميتوكوندريا في الكائنات الحية المختلفة.
ومن المثير للاهتمام أن نلاحظ مصير الميتوكوندريا في خلايا الخميرة. في ظل الظروف الهوائية، تحتوي خلايا الخميرة على ميتوكوندريا نموذجية ذات أعراف محددة بوضوح. عندما يتم نقل الخلايا إلى الظروف اللاهوائية (على سبيل المثال، عندما يتم زراعتها فرعيًا أو عند نقلها إلى جو من النيتروجين)، لا يتم اكتشاف الميتوكوندريا النموذجية في السيتوبلازم، وتكون حويصلات الغشاء الصغيرة مرئية بدلاً من ذلك. اتضح أنه في ظل الظروف اللاهوائية، لا تحتوي خلايا الخميرة على سلسلة تنفسية كاملة (السيتوكرومات b وa غائبة). عندما يتم تهوية الثقافة، هناك تحريض سريع للتخليق الحيوي لإنزيمات الجهاز التنفسي، وزيادة حادة في استهلاك الأكسجين، وتظهر الميتوكوندريا الطبيعية في السيتوبلازم.
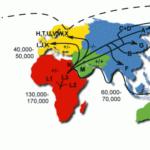
استيطان البشر على الأرض 
الجينوم البلاستيدي
مثل الميتوكوندريا، تتمتع البلاستيدات الخضراء بنظامها الجيني الخاص الذي يضمن تخليق عدد من البروتينات داخل البلاستيدات نفسها. تم العثور على الحمض النووي، ومختلف الحمض النووي الريبي (RNA) والريبوسومات في مصفوفة البلاستيدات الخضراء. اتضح أن الحمض النووي للبلاستيدات الخضراء يختلف بشكل حاد عن الحمض النووي للنواة. ويمثلها جزيئات حلقية يصل طولها إلى 40-60 ميكرون، ويبلغ وزنها الجزيئي 0.8-1.3x108 دالتون. يمكن أن يكون هناك عدة نسخ من الحمض النووي في البلاستيدات الخضراء الواحدة. وهكذا، في البلاستيدات الخضراء الفردية للذرة هناك 20-40 نسخة من جزيئات الحمض النووي. إن مدة الدورة ومعدل تكرار الحمض النووي النووي والبلاستيدات الخضراء، كما هو موضح في خلايا الطحالب الخضراء، لا يتطابقان. الحمض النووي للبلاستيدات الخضراء غير معقد مع الهستونات. كل هذه الخصائص للحمض النووي للبلاستيدات الخضراء قريبة من خصائص الحمض النووي للخلايا بدائية النواة. علاوة على ذلك، فإن تشابه الحمض النووي للبلاستيدات الخضراء والبكتيريا يتعزز بشكل أكبر من خلال حقيقة أن التسلسلات التنظيمية النسخية الرئيسية (المروجين والإنهاء) هي نفسها. يتم تصنيع جميع أنواع الحمض النووي الريبي (الرسول، النقل، الريبوسوم) على الحمض النووي للبلاستيدات الخضراء. يشفر الحمض النووي للبلاستيدات الخضراء الرنا الريباسي (rRNA)، وهو جزء من ريبوسومات هذه البلاستيدات، التي تنتمي إلى النوع 70S بدائيات النواة (يحتوي على 16S و23S rRNA). ريبوسومات البلاستيدات الخضراء حساسة للمضاد الحيوي الكلورامفينيكول، الذي يثبط تخليق البروتين في الخلايا بدائية النواة.
أرز.
تكوين دبابيس الشعر في الحمض النووي لبعض البلاستيدات الخضراء.
وكما هو الحال في حالة البلاستيدات الخضراء، فإننا نواجه مرة أخرى مشكلة
وجود نظام خاص لتخليق البروتين يختلف عن
واحد في القفص.
جددت هذه الاكتشافات الاهتمام بنظرية التكافلية
أصل البلاستيدات الخضراء. فكرة أن البلاستيدات الخضراء
نشأت بسبب مزيج من الخلايا غير المتجانسة مع بدائية النواة
الطحالب الخضراء المزرقة، والتي تم التعبير عنها في مطلع التاسع عشر والعشرين
قرون (A. S. Fomintsin، K. S. Merezhkovsky) يجده مرة أخرى
تأكيد. ويدعم هذه النظرية شيء مثير للدهشة.
التشابه في بنية البلاستيدات الخضراء والطحالب الخضراء المزرقة،
التشابه مع ميزاتها الوظيفية الرئيسية، و
في المقام الأول مع القدرة على عمليات التمثيل الضوئي.
أرز. تكوين الجينوم البلاستيد في الأرابيدوبسيس.
هناك العديد من الحقائق المعروفة عن التعايش الداخلي الحقيقي للخضراء الزرقاء
الطحالب مع خلايا النباتات السفلية والطفيليات، حيث
أنها تعمل وتزود الخلية المضيفة بمنتجات التمثيل الضوئي.
اتضح أنه يمكن أيضًا اختيار البلاستيدات الخضراء المعزولة
بواسطة بعض الخلايا وتستخدمها كتعايش داخلي.
في العديد من اللافقاريات (الدوارات والرخويات) التي تتغذى
الطحالب العليا التي يهضمونها سليمة
تجد البلاستيدات الخضراء نفسها داخل خلايا الغدد الهضمية.
وهكذا تم العثور على خلايا في بعض الرخويات العاشبة
البلاستيدات الخضراء السليمة مع خلايا التمثيل الضوئي العاملة
الأنظمة التي تم رصد نشاطها من خلال إدراج C14O2.
كما اتضح، يمكن إدخال البلاستيدات الخضراء في السيتوبلازم
خلايا زراعة الخلايا الليفية في الفأر عن طريق كثرة الخلايا. لكن
ولم يتعرضوا للهجوم بواسطة الهيدرولاز. مثل هذه الخلايا التي شملت
البلاستيدات الخضراء الخضراء، يمكن أن تنقسم لمدة خمسة أجيال،
بينما ظلت البلاستيدات الخضراء سليمة ونفذت
تفاعلات التمثيل الضوئي. بذلت محاولات للزراعة
البلاستيدات الخضراء في البيئات الاصطناعية: يمكن للبلاستيدات الخضراء القيام بعملية التمثيل الضوئي،
تم فيها تصنيع الحمض النووي الريبوزي (RNA)، وبقيت سليمة لمدة 100 ساعة،
وقد لوحظت الانقسامات حتى خلال 24 ساعة. ولكن بعد ذلك حدث ما حدث
انخفاض في نشاط البلاستيدات الخضراء وماتوا.
وأظهرت هذه الملاحظات وعدد من الدراسات البيوكيميائية
أن ميزات الاستقلالية التي تمتلكها البلاستيدات الخضراء موجودة أيضًا
غير كافية للحفاظ على وظائفها وموضوعاتها على المدى الطويل
أكثر لتكاثرهم.
في الآونة الأخيرة، كان من الممكن فك تشفير التسلسل بأكمله بالكامل
النيوكليوتيدات في جزيء الحمض النووي الحلقي للبلاستيدات الخضراء
نباتات أعلى. يمكن لهذا الحمض النووي أن يشفر ما يصل إلى 120 جينًا،
من بينها: 4 جينات RNA الريبوسومية، 20 بروتينات ريبوسومية من البلاستيدات الخضراء،
جينات بعض الوحدات الفرعية من بوليميريز RNA البلاستيدات الخضراء، عدة
البروتينات الأول والثاني من الأنظمة الضوئية، 9 من 12 وحدة فرعية من إنزيم ATP Synthetase،
أجزاء من بروتينات مجمعات سلسلة نقل الإلكترون، واحد
من وحدات فرعية من كربوكسيلاز ثنائي فوسفات الريبولوز (الإنزيم الرئيسي
رابط ثاني أكسيد الكربون)، 30 جزيء tRNA و40 جزيءًا آخر لا يزال غير معروف
البروتينات. ومن المثير للاهتمام وجود مجموعة مماثلة من الجينات في الحمض النووي للبلاستيدات الخضراء
وجدت في مثل هؤلاء الممثلين البعيدين للأعلى
النباتات مثل التبغ وطحالب الكبد.
يتم التحكم في الجزء الأكبر من بروتينات البلاستيدات الخضراء بواسطة الطاقة النووية
الجينوم. وتبين أن عدداً من أهم البروتينات والإنزيمات،
وبالتالي، عمليات التمثيل الغذائي للبلاستيدات الخضراء
تحت السيطرة الجينية للنواة. نعم الخلوية
تتحكم النواة في المراحل الفردية لتخليق الكلوروفيل، والكاروتينات،
الدهون والنشا. والعديد منها تحت السيطرة النووية
إنزيمات المرحلة المظلمة من عملية التمثيل الضوئي والإنزيمات الأخرى
بما في ذلك بعض مكونات سلسلة نقل الإلكترون.
تقوم الجينات النووية بتشفير بوليميريز الحمض النووي ومركب إنزيم الأمينو أسيل - الحمض الريبي النووي النقال
البلاستيدات الخضراء. تحت سيطرة الجينات النووية هناك عدد كبير
جزء من البروتينات الريبوسومية. كل هذه البيانات تجعلنا نتحدث
حول البلاستيدات الخضراء، وكذلك حول الميتوكوندريا، كهياكل
باستقلالية محدودة.
يحدث نقل البروتينات من السيتوبلازم إلى البلاستيدات من حيث المبدأ
مشابهة لتلك الموجودة في الميتوكوندريا. وهنا أيضا في أماكن الالتقاء
تحتوي الأغشية الخارجية والداخلية للبلاستيدات الخضراء على أغشية مكونة للقناة
البروتينات المتكاملة التي تتعرف على تسلسل الإشارة
يتم تصنيع بروتينات البلاستيدات الخضراء في السيتوبلازم ونقلها
لهم في سدى المصفوفة. البروتينات المستوردة من السدى وفقا ل
قد تتضمن تسلسلات الإشارة الإضافية
إلى الأغشية البلاستيدية (الثيلاكويدات، الصفائح اللحمية، الخارجية
والغشاء الداخلي) أو موضعي في السدى، يدخل
في تكوين الريبوسومات ومجمعات الإنزيمات لدورة كالفين و
إلخ.
تشابه مذهل في عمليات البنية والطاقة
في البكتيريا والميتوكوندريا من ناحية، وفي اللون الأزرق والأخضر
الطحالب والبلاستيدات الخضراء - من ناحية أخرى، بمثابة حجة مقنعة
لصالح نظرية الأصل التكافلي لهذه العضيات.
ووفقا لهذه النظرية، فإن ظهور خلية حقيقية النواة
مرت بعدة مراحل من التعايش مع الخلايا الأخرى.
في المرحلة الأولى، خلايا مثل البكتيريا اللاهوائية غير المتجانسة
وشملت البكتيريا الهوائية التي تحولت إلى الميتوكوندريا.
بالتوازي مع هذا، في الخلية المضيفة، يوجد حامل جيني بدائيات النواة
وتشكل نواة مفصولة عن السيتوبلازم. حتى يتمكنوا من ذلك
تنشأ خلايا حقيقية النواة غيرية التغذية. معاد
العلاقات التكافلية الداخلية بين حقيقيات النوى الأولية
أدت الخلايا والطحالب الخضراء المزرقة إلى ظهورها
أنها تحتوي على هياكل مثل البلاستيدات الخضراء، التي تسمح للخلايا بالعمل
عمليات التخليق الذاتي ولا تعتمد على وجود المواد العضوية
ركائز (الشكل 236). في طور التحول إلى مثل هذا المركب
النظام الحي جزء من المعلومات الوراثية للميتوكوندريا
ويمكن للبلاستيد أن يتغير وينتقل إلى النواة. على سبيل المثال
يتم تشفير ثلثي البروتينات الريبوسومية للبلاستيدات الخضراء البالغ عددها 60
في النواة ويتم تصنيعها في السيتوبلازم ثم دمجها
إلى ريبوسومات البلاستيدات الخضراء، التي تمتلك جميع خصائص بدائيات النواة
الريبوسومات هذه حركة جزء كبير من بدائيات النوى
أدت الجينات الموجودة في النواة إلى حقيقة أن هذه العضيات الخلوية،
بعد أن احتفظوا بجزء من استقلالهم السابق، أصبحوا تحت سيطرة الخلوية
النواة، والتي تحدد إلى حد كبير جميع الخلايا الرئيسية
المهام.
موسكو، 4 يوليو— ريا نوفوستي، آنا أورمانتسيفا. من لديه الجينوم الأكبر؟ كما تعلمون، فإن بعض المخلوقات لديها بنية أكثر تعقيدا من غيرها، وبما أن كل شيء مكتوب في الحمض النووي، فيجب أن ينعكس ذلك أيضا في الكود الخاص به. اتضح أن الشخص الذي لديه كلام متطور يجب أن يكون أكثر تعقيدًا من دودة مستديرة صغيرة. ومع ذلك، إذا قارنتنا مع دودة من حيث عدد الجينات، فستحصل على نفس الشيء تقريبًا: 20 ألف جين من Caenorhabditis elegans مقابل 20-25 ألف من Homo sapiens.
والأكثر إهانة لـ "تاج المخلوقات الأرضية" و "ملك الطبيعة" هو المقارنات مع الأرز والذرة - 50 ألف جين مقارنة بالإنسان 25.
ومع ذلك، ربما نعتقد خطأ؟ الجينات هي "صناديق" يتم فيها تعبئة النيوكليوتيدات - "حروف" الجينوم. ربما عدهم؟ لدى البشر 3.2 مليار زوج من النيوكليوتيدات. لكن عين الغراب اليابانية (باريس جابونيكا) - وهي نبات جميل ذو زهور بيضاء - تحتوي على 150 مليار زوج قاعدي في جينومها. اتضح أن الشخص يجب أن يكون أبسط 50 مرة من بعض الزهور.
وتبين أن الأسماك الرئوية (الأسماك الرئوية - التي تمتلك تنفسًا خياشيميًا ورئويًا) أكثر تعقيدًا بـ 40 مرة من البشر. ربما تكون جميع الأسماك أكثر تعقيدًا إلى حد ما من البشر؟ لا. تحتوي سمكة الفوجو السامة، التي يعد اليابانيون منها طعامًا شهيًا، على جينوم أصغر بثماني مرات من جينوم البشر وأصغر 330 مرة من جينوم السمكة الرئوية بروتوبتيرا.
كل ما تبقى هو حساب الكروموسومات - لكن هذا يربك الصورة أكثر. كيف يمكن للإنسان أن يتساوى في عدد الكروموسومات مع شجرة الدردار، والشمبانزي مع الصرصور؟

واجه علماء الأحياء التطورية وعلماء الوراثة هذه المفارقات منذ زمن طويل. لقد اضطروا إلى الاعتراف بأن حجم الجينوم، مهما حاولنا حسابه، لا علاقة له على الإطلاق بتعقيد تنظيم الكائنات الحية. أُطلق على هذه المفارقة اسم "لغز القيمة C"، حيث C هي كمية الحمض النووي في الخلية (مفارقة القيمة C، الترجمة الدقيقة هي "مفارقة حجم الجينوم"). ومع ذلك، توجد بعض الارتباطات بين الأنواع والممالك.
© رسم توضيحي لريا نوفوستي. أ. بوليانينا

© رسم توضيحي لريا نوفوستي. أ. بوليانينا
فمن الواضح، على سبيل المثال، أن حقيقيات النوى (الكائنات الحية التي تحتوي خلاياها على نواة) لديها، في المتوسط، جينومات أكبر من بدائيات النوى (الكائنات الحية التي لا تحتوي خلاياها على نواة). تمتلك الفقاريات، في المتوسط، جينومات أكبر من اللافقاريات. ومع ذلك، هناك استثناءات لم يتمكن أحد من تفسيرها بعد.

كانت هناك اقتراحات بأن حجم الجينوم يرتبط بطول دورة حياة الكائن الحي. وباستخدام النباتات كمثال، جادل بعض العلماء بأن الأنواع المعمرة لها جينومات أكبر من النباتات الحولية، وعادة ما يكون الاختلاف عدة مرات. وأصغر الجينومات تنتمي إلى نباتات سريعة الزوال، والتي تمر بالدورة الكاملة من الولادة إلى الموت في غضون أسابيع قليلة. تتم حاليًا مناقشة هذه المشكلة بنشاط في الأوساط العلمية.
يوضح الباحث الرائد في معهد الوراثة العامة. إن آي فافيلوفا من الأكاديمية الروسية للعلوم، أستاذ جامعة تكساس للميكانيكا الزراعية وجامعة غوتنغن كونستانتين كروتوفسكي: "حجم الجينوم لا يرتبط بمدة دورة حياة الكائن الحي! على سبيل المثال، هناك أنواع داخل نفس الجنس الذي له نفس حجم الجينوم، ولكن قد يختلف في متوسط العمر المتوقع عشرات، إن لم يكن مئات المرات. بشكل عام، هناك علاقة بين حجم الجينوم والتقدم التطوري وتعقيد التنظيم، ولكن مع العديد من الاستثناءات. يرتبط الحجم بصيغة الصيغة الصبغية (رقم النسخة) للجينوم (وتوجد متعددات الصيغة الصبغية في كل من النباتات والحيوانات) وكمية الحمض النووي المتكرر للغاية (التكرارات البسيطة والمعقدة، والترانسبوزونات والعناصر المتنقلة الأخرى)."

هناك أيضًا علماء لديهم وجهة نظر مختلفة حول هذه القضية.
جميع الكروموسومات والحمض النووي للميتوكوندريا. حاليًا، تُستخدم هذه البيانات بنشاط في جميع أنحاء العالم في الأبحاث الطبية الحيوية. كشف التسلسل الكامل أن الجينوم البشري يحتوي على 20-25 ألف جين نشط، وهو أقل بكثير مما كان متوقعا في بداية المشروع (حوالي 100 ألف) - أي أن 1.5٪ فقط من جميع المواد الوراثية تشفر البروتينات أو الحمض النووي الريبي الوظيفي. والباقي عبارة عن حمض نووي غير مشفر، يُطلق عليه غالبًا الحمض النووي غير المرغوب فيه، ولكن ثبت أنه يلعب دورًا مهمًا في تنظيم نشاط الجينات وتشكيل الكائن الحي بأكمله أثناء النمو.
الخصائص
الكروموسومات
يحتوي الجينوم على 23 زوجًا من الكروموسومات: 22 زوجًا من الكروموسومات الجسدية، بالإضافة إلى زوج من الكروموسومات الجنسية X وY. في البشر، يكون جنس الذكر غير متجانس ويتم تحديده من خلال وجود كروموسوم Y. تحتوي الخلايا الجسدية ثنائية الصيغة الصبغية الطبيعية على 46 كروموسومًا.
الجينات
وتشير التقديرات الأولية إلى وجود أكثر من 100 ألف جين في الجينوم البشري. وبحسب نتائج مشروع الجينوم البشري، بلغ عدد الجينات، أو بالأحرى إطارات القراءة المفتوحة، نحو 28 ألف جينة. فيما يتعلق بتحسين طرق البحث (التنبؤ) بالجينات، من المتوقع حدوث انخفاض إضافي في عدد الجينات.
عدد الجينات البشرية ليس أكبر بكثير من عدد الجينات في الكائنات الحية البسيطة، على سبيل المثال، الدودة المستديرة أنواع معينة انيقةأو الذباب ذبابة الفاكهة سوداء البطن. ويرجع ذلك إلى حقيقة أن الربط البديل ممثل على نطاق واسع في الجينوم البشري. يتيح لك الربط البديل الحصول على عدة سلاسل بروتينية مختلفة من جين واحد. ونتيجة لذلك، تبين أن البروتين البشري أكبر بكثير من بروتين الكائنات الحية قيد النظر. تحتوي معظم الجينات البشرية على إكسونات متعددة، وغالبًا ما تكون الإنترونات أطول بكثير من الإكسونات المجاورة في الجين.
يتم توزيع الجينات بشكل غير متساو عبر الكروموسومات. يحتوي كل كروموسوم على مناطق غنية بالجينات وفقيرة بالجينات. ترتبط هذه المناطق بانحناءات الكروموسومات (خطوط عبر الكروموسوم يمكن رؤيتها تحت المجهر) ومع مناطق غنية بـ CG. في الوقت الحاضر، أهمية هذا التوزيع غير المتكافئ للجينات ليست مفهومة تماما.
بالإضافة إلى جينات ترميز البروتين، يحتوي الجينوم البشري على آلاف جينات الحمض النووي الريبي (RNA)، بما في ذلك الحمض النووي الريبي الناقل (tRNA)، والحمض النووي الريبي الريباسي (RNA)، والحمض النووي الريبي الميكروي (microRNA)، وغيرها من تسلسلات الحمض النووي الريبي (RNA) غير المشفرة للبروتين.
ويعتمد أسلوب آخر للحصول على التسلسلات التنظيمية على مقارنة الجينات البشرية والأسماك المنتفخة. تتشابه التسلسلات الجينية والتسلسلات التنظيمية لدى البشر وأسماك الفوجو إلى حد كبير، لكن جينوم أسماك الفوجو يحتوي على حجم أقل بـ 8 مرات من "الحمض النووي غير المرغوب فيه". إن "تماسك" جينوم الأسماك يجعل من السهل جدًا البحث عن التسلسلات التنظيمية للجينات. كائنات أخرى في الجينومتشكل تسلسلات ترميز البروتين (التسلسلات العديدة التي تشكل الإكسونات) أقل من 1.5% من الجينوم. وبدون الأخذ في الاعتبار التسلسلات التنظيمية المعروفة، يحتوي الجينوم البشري على الكثير من الأشياء التي تبدو وكأنها شيء مهم، ولكن وظيفتها، إن وجدت، غير واضحة حاليًا. وفي الواقع، تشغل هذه الكائنات ما يصل إلى 97% من إجمالي حجم الجينوم البشري. تشمل هذه الكائنات ما يلي:
التصنيف المقدم ليس شاملا. لم يتم تصنيف معظم الأشياء على الإطلاق من قبل المجتمع العلمي العالمي في الوقت الحالي. من المرجح أن تكون التسلسلات المقابلة قطعة أثرية تطورية. في النسخة الحديثة من الجينوم، تم إيقاف وظيفتها، ويشار إلى هذه الأجزاء من الجينوم من قبل الكثيرين باسم "الحمض النووي غير المرغوب فيه". ومع ذلك، هناك مجموعة من الأدلة التي تشير إلى أن هذه الأشياء لها وظيفة ما غير مفهومة تمامًا في الوقت الحالي. الجينات الكاذبةالفيروساتحوالي 1% من الجينوم البشري تشغله جينات الفيروسات القهقرية المدمجة (الفيروسات القهقرية الذاتية). هذه الجينات عادة لا تفيد المضيف، ولكن هناك استثناءات. وهكذا، منذ حوالي 43 مليون سنة، دخلت جينات الفيروسات القهقرية التي عملت على بناء غلاف الفيروس، إلى جينوم أسلاف القرود والبشر. في البشر والقردة، تشارك هذه الجينات في عمل المشيمة. تم دمج معظم الفيروسات القهقرية في جينوم أسلاف الإنسان منذ أكثر من 25 مليون سنة. لم يتم العثور على فيروسات قهقرية داخلية مفيدة حتى الآن بين الفيروسات القهقرية الذاتية البشرية الأصغر سنًا. محتوى معلومات الجينوم البشريأنظر أيضاملحوظات
|
إن جينوم السمكة المنتفخة أصغر بحوالي ثماني مرات من الجينوم البشري وأصغر 330 مرة من جينوم السمكة الرئوية بروتوبتيرا. ما هي "الأشباح" التي تعيش في "مقابر الجينوم"، وما مقدار القمامة الموجودة في حمضنا النووي؟
قال عالم الأحياء الجزيئية الشهير ديفيد بيني من مركز ألين ويلسون للإيكولوجيا الجزيئية والتطور بجامعة ماسي في نيوزيلندا ذات مرة: "كنت سأشعر بالفخر الشديد لكوني جزءًا من المجموعة التي طورت جينوم الإشريكية القولونية. ومع ذلك، لن أعترف أبدًا بأنني شاركت في تصميم الجينوم البشري. لا يمكن لأي جامعة أن تدمر هذا المشروع إلى هذا الحد”. تعد كمية النفايات الموجودة في حمضنا النووي واحدة من أهم المواضيع في المجتمع العلمي. تندلع معارك كلامية حقيقية بين العلماء حول هذه القضية.
قليلا من علم الوراثة الجزيئية
أذكر أن أساس نقل المعلومات الوراثية هو جزيء الحمض النووي المزدوج تقطعت بهم السبل. وهو عبارة عن بوليمر مكون من أربعة أنواع من المونومرات (النيوكليوتيدات): الأدينين (A)، والثايمين (T)، والسيتوزين (C)، والجوانين (G) - ويتم ترتيبه في الكروموسومات. لدى البشر 23 زوجًا من الكروموسومات الموجودة في النواة (22 زوجًا من الكروموسومات غير الجنسية وزوجًا واحدًا من الكروموسومات الجنسية). إنها تشكل أساس الجينوم الخاص بنا (يحتوي 37 جينًا آخر على DNA الميتوكوندريا الدائري). إذا أخذنا خلية بشرية واحدة، وقمنا بخياطة مجموعة الكروموسومات الثنائية (المزدوجة) بأكملها معًا ومددناها في خيط، فسنحصل على جزيء يبلغ طوله مترين، ويتكون من ستة مليارات زوج أساسي (نيوكليوتيدات). ثلاثة مليارات من الأب وثلاثة من أمي.

النوع الأكثر دراسة من تسلسل الحمض النووي الوظيفي هو الجينات التي تشفر البروتينات. تتم قراءة جزيء الحمض النووي الريبي (RNA) من هذه الجينات، والذي يلعب بعد ذلك دور المصفوفة لتخليق البروتينات وتحديد تسلسل الأحماض الأمينية الخاصة بها. يمكن تقسيم جزء الترميز في جزيء الحمض النووي الريبي (RNA) إلى ثلاثة توائم من النيوكليوتيدات (الكودونات)، والتي إما تتوافق مع حمض أميني معين أو تحدد نقطة النهاية لتخليق البروتين (كودونات التوقف). تسمى قاعدة مطابقة الكودونات مع الأحماض الأمينية بالشفرة الجينية. على سبيل المثال، رموز الكودون الخليجي للحمض الأميني ألانين.
دعونا نقارن الجينات؟
كان يُعتقد ذات يوم أن مثل هذا الكائن المعقد مثل الإنسان يجب أن يكون لديه الكثير من الجينات. عندما كان مشروع الجينوم البشري على وشك الانتهاء، أجرى العلماء لعبة رهان: كم عدد الجينات التي سيتم اكتشافها؟
تخيل دهشتهم عندما تبين أن عدد الجينات الموجودة في الشخص والدودة المستديرة صغيرة أنواع معينة انيقةنفس الشيء تقريبًا. تحتوي الدودة على حوالي 20 ألف جين، ولدينا 20-25 ألف جين.
بالنسبة لـ "تاج الخليقة"، فإن هذه الحقيقة مهينة للغاية، خاصة عندما تأخذ في الاعتبار أن هناك العديد من الكائنات الحية ذات الجينوم الأكبر (جينوم السمكة الرئوية بروتوبتروس، وجينوم السمكة الرئوية بروتوبتروس). بروتوبتيروس إثيوبيكوس، 40 مرة أكثر من الإنسان)، ومع عدد أكبر من الجينات (الأرز لديه 32-50 ألف جين).
لكن في الواقع، أقل من 2% من رموز الجينوم البشري لأي بروتينات. ما هي الـ 98٪ الأخرى اللازمة؟ ربما يكمن سر تعقيدنا؟ اتضح أن هناك مناطق مهمة غير مشفرة في الحمض النووي. على سبيل المثال، هذه هي مناطق المحفزات - تسلسلات النيوكليوتيدات التي يقع عليها إنزيم بوليميراز RNA ومن حيث يبدأ تركيب جزيء RNA. هذه مواقع ربط لعوامل النسخ - البروتينات التي تنظم وظيفة الجينات. هذه هي التيلوميرات، التي تحمي نهايات الكروموسومات، والسينتروميرات، وهي ضرورية للفصل الصحيح للكروموسومات إلى أقطاب مختلفة من الخلايا أثناء الانقسام. بعض جزيئات الحمض النووي الريبي (RNA) التنظيمية معروفة (على سبيل المثال، microRNAs التي تمنع تخليق بروتينات الجينات المقابلة في messenger RNA - نسخة من الجين المصدر)، وكذلك جزيئات الحمض النووي الريبي (RNA) التي تشكل جزءًا من المجمعات الأنزيمية المهمة - على سبيل المثال، الريبوسومات ، التي تجمع البروتينات من الأحماض الأمينية الفردية، وتتحرك على طول الحمض النووي الريبي المرسال. هناك أمثلة أخرى على مناطق مهمة غير مشفرة في الحمض النووي.
ومع ذلك، فإن معظم الجينوم لدينا يشبه الصحراء: تسلسلات متكررة، وبقايا الفيروسات "الميتة" التي تم بناؤها في جينومات أسلافنا منذ فترة طويلة؛ وما يسمى بالعناصر المتحركة الأنانية - تسلسلات الحمض النووي التي يمكن أن تقفز من جزء من الجينوم إلى آخر؛ جينات كاذبة مختلفة - تسلسلات النيوكليوتيدات التي فقدت القدرة على تشفير البروتينات نتيجة للطفرات، لكنها لا تزال تحتفظ ببعض خصائص الجينات. هذه ليست قائمة كاملة بـ "الأشباح" الذين يعيشون في "مقبرة الجينوم".
الحد الأدنى من الماوس
هناك وجهة نظر مفادها أن معظم الجينوم البشري غير وظيفي. في عام 2004 المجلة طبيعةنشر مقالًا يصف الفئران التي تم قطع أجزاء كبيرة من الحمض النووي غير المشفر من جينومها بقياس 0.8 وحتى 1.5 مليون نيوكليوتيدات. وتبين أن هذه الفئران لا تختلف عن الفئران العادية في بنية الجسم أو النمو أو العمر المتوقع أو القدرة على ترك النسل. بالطبع، قد تمر بعض الاختلافات دون أن يلاحظها أحد، ولكن بشكل عام كانت هذه حجة جدية لصالح وجود "الحمض النووي غير المرغوب فيه"، والذي يمكن التخلص منه دون أي عواقب خاصة. بطبيعة الحال، سيكون من المثير للاهتمام أن نستبعد ليس بضعة ملايين من النيوكليوتيدات، بل مليارا منها، بحيث لا نترك سوى تسلسلات جينية متوقعة وعناصر وظيفية معروفة. هل سيكون من الممكن تطوير مثل هذا "الفأر البسيط" وهل سيكون قادرًا على الوجود بشكل طبيعي؟ هل يستطيع الإنسان أن يتأقلم مع جينوم يبلغ طوله نصف متر فقط؟ ربما في يوم من الأيام سوف نكتشف ذلك. وفي الوقت نفسه، هناك حجة مهمة أخرى لصالح وجود الحمض النووي غير المرغوب فيه وهي وجود كائنات حية متقاربة إلى حد ما ذات أحجام جينومية مختلفة جدًا.
إن جينوم السمكة المنتفخة أصغر بنحو ثماني مرات من الجينوم البشري (على الرغم من أنه يحتوي على نفس العدد من الجينات تقريبًا)، وأصغر بـ 330 مرة من جينوم سمكة البروتوبتيرا المذكورة بالفعل. إذا كان كل نيوكليوتيد في الجينوم وظيفيًا، فمن غير الواضح لماذا يحتاج البصل إلى جينوم أكبر بخمس مرات من جينومنا؟
لفت عالم الأحياء التطوري سوسومو أونو الانتباه إلى الاختلافات الهائلة في أحجام جينومات الكائنات الحية المماثلة. ويُعتقد أن أونو هو من صاغ مصطلح "الحمض النووي غير المرغوب فيه". في عام 1972، قبل فترة طويلة من قراءة الجينوم البشري، أعرب أونو عن أفكار معقولة حول عدد الجينات في الجينوم البشري وكمية "النفايات" فيه. وفي مقالته "الكثير من الحمض النووي غير المرغوب فيه في جينومنا"، يشير إلى أنه لا بد أن يكون هناك حوالي 30 ألف جين في الجينوم البشري. تبين أن هذا الرقم، الذي لم يكن واضحًا على الإطلاق في ذلك الوقت، كان قريبًا بشكل مدهش من الرقم الحقيقي، والذي تم اكتشافه بعد عقود. بالإضافة إلى ذلك، يقدم أونو تقديرًا للجزء الوظيفي للجينوم (6%)، معلنًا أن أكثر من 90% من الجينوم البشري خردة.
متخصص في علم الأحياء التطوري وعلم الجينوم التكاملي، أستاذ مشارك في جامعة جيلف الكندية في أونتاريو:"إن اختبار البصل هو اختبار جيد لأي شخص يعتقد أن كل نيوكليوتيد في الجينوم البشري له وظيفة محددة. وبغض النظر عن ماهية هذه الوظائف المفترضة، اسأل نفسك: لماذا تحتاج البصلة النموذجية إلى جينوم أكبر بخمس مرات من جينومك؟
البحث أو سلة المهملات؟
تم تحدي فكرة وجود الحمض النووي غير المرغوب فيه من خلال مشروع ENCODE - موسوعة عناصر الحمض النووي (تم نشر نتائجه الأولى في المجلة طبيعةفي عام 2012). بعد تلقي العديد من البيانات التجريبية التي تتفاعل فيها أجزاء الجينوم البشري مع البروتينات المختلفة، وتشارك في النسخ - تخليق نسخ الحمض النووي الريبي (RNA) من الجينات للترجمة اللاحقة (تخليق البروتين من الأحماض الأمينية على مصفوفة الحمض النووي الريبي المرسال) - أو العمليات الكيميائية الحيوية الأخرى، توصل الباحثون إلى استنتاج مفاده أن أكثر من 80% من الجينوم البشري يعمل بطريقة أو بأخرى. وبطبيعة الحال، أثارت هذه الأطروحة نقاشا ساخنا في المجتمع العلمي.
إحدى المقالات الأكثر إثارة للسخرية نشرها دان جور، عالم المعلومات الحيوية التطورية الجزيئية والأستاذ بجامعة هيوستن، وزملاؤه في عام 2013 في مجلة بيولوجيا الجينوم وتطوره، بعنوان: "في خلود أجهزة التلفاز: "الوظيفة" في الجينوم البشري وفقًا للإنجيل الخالي من التطور من ENCODE." لاحظ مؤلفوها أن الأعضاء الفرديين في اتحاد ENCODE يختلفون حول مقدار وظيفة الجينوم. لذلك، سرعان ما أوضح أحدهم في المجلة جينوميكرونأننا لا نتحدث عن 80% من التسلسلات الوظيفية في الجينوم، بل عن 40%، بل أخرى (في المقال في العلمية الأمريكية) وخفض الرقم تمامًا إلى 20٪، لكنه استمر في الوقت نفسه في الإصرار على ضرورة حذف مصطلح "الحمض النووي غير المرغوب فيه" من المعجم.
وفقا لمؤلفي المقال "حول خلود أجهزة التلفزيون"، فإن أعضاء اتحاد ENCODE يفسرون مصطلح "وظيفة" بحرية كبيرة. على سبيل المثال، هناك بروتينات تسمى الهستونات. يمكنهم ربط جزيء الحمض النووي ومساعدته على طيه بشكل مضغوط. يمكن أن تخضع الهستونات لتعديلات كيميائية معينة. وفقًا لـ ENCODE، فإن الوظيفة المفترضة لأحد تعديلات الهيستون هذه هي "تفضيل أن يكون عند الطرف 5" من الجينات (النهاية 5" هي نهاية الجين الذي تتحرك منه إنزيمات بوليميريز DNA و RNA عند نسخ الحمض النووي أو أثناء النسخ). ويشير المعارضون إلى أنه "بنفس الطريقة، يمكن للمرء أن يقول إن وظيفة البيت الأبيض هي احتلال المساحة الموجودة في 1600 شارع بنسلفانيا، واشنطن العاصمة".
هناك أيضًا مشكلة في إسناد الوظائف إلى أقسام الحمض النووي. لنفترض أن البروتين المهم لعمل الخلية قادر على الارتباط بقسم معين من الحمض النووي، وبالتالي فإن الترميز يعين "وظيفة" لهذا القسم. على سبيل المثال، يرتبط عامل نسخ معين - البروتين الذي يبدأ تخليق الحمض النووي الريبي المرسال - بتسلسل النيوكليوتيدات التالي: TATAAA. خذ بعين الاعتبار تسلسلين TATAAA متطابقين في أجزاء مختلفة من الجينوم. بعد أن يرتبط عامل النسخ بالتسلسل الأول، يبدأ تركيب جزيء الحمض النووي الريبي (RNA)، والذي يعمل كقالب لتخليق بروتين مهم آخر. الطفرات (استبدال أي من النيوكليوتيدات) في هذا التسلسل سوف تتسبب في قراءة الحمض النووي الريبي (RNA) بشكل سيئ، ولن يتم تصنيع البروتين، وهذا على الأرجح سيؤثر سلبًا على بقاء الكائن الحي. لذلك، سيتم الحفاظ على تسلسل TATAAA الصحيح في مكان معين في الجينوم عن طريق الانتقاء الطبيعي، وفي هذه الحالة يكون من المناسب التحدث عن وظيفتها.
نشأ تسلسل TATAAA آخر في الجينوم لأسباب عشوائية. وبما أنه مطابق للعامل الأول، فإن عامل النسخ يرتبط به أيضًا. ولكن لا يوجد جين قريب، وبالتالي فإن الارتباط لا يؤدي إلى شيء. إذا حدثت طفرة في هذه المنطقة فلن يتغير شيء ولن يعاني الجسم. وفي هذه الحالة لا فائدة من الحديث عن وظيفة القسم الثاني من TATAAA. ومع ذلك، قد يتبين أن وجود عدد كبير من تسلسلات TATAAA في الجينوم بعيدًا عن الجينات هو ببساطة ضروري لربط عامل النسخ وتقليل تركيزه الفعال. في هذه الحالة، سينظم الانتقاء عدد هذه التسلسلات في الجينوم.
لإثبات أن قطعة معينة من الحمض النووي فعالة، لا يكفي إثبات أن بعض العمليات البيولوجية (على سبيل المثال، ربط الحمض النووي) تحدث في تلك المنطقة. يكتب أعضاء اتحاد ENCODE أن الوظيفة تمتلكها أجزاء من الحمض النووي التي تشارك في النسخ. "ولكن لماذا من الضروري التركيز على حقيقة أن 74.7% من الجينوم منسوخ، بينما يمكننا القول أن 100% من الجينوم يشارك في عملية كيميائية حيوية قابلة للتكاثر - النسخ المتماثل!" يمزح جور مرة أخرى.
تكرار
النسخ المتماثل (من اللاتينية النسخ المتماثل - التجديد) هو عملية تصنيع جزيء ابنة من حمض الديوكسي ريبونوكلييك على المصفوفة الأم. خلال الانقسام التالي، تتلقى كل خلية من الخلايا الوليدة نسخة واحدة من جزيء الحمض النووي المطابق للحمض النووي للخلية الأم الأصلية. يتم تنفيذ تكرار الحمض النووي بواسطة الريبلوسوم، وهو مركب إنزيمي معقد يتكون من 15-20 بروتينًا مختلفًا.
المعيار الجيد لوظيفة منطقة الحمض النووي هو أن الطفرات فيها ضارة جدًا ولا يتم ملاحظة تغييرات كبيرة في هذه المنطقة من جيل إلى جيل. كيفية التعرف على هذه المناطق؟ وهنا يأتي دور المعلوماتية الحيوية للإنقاذ، وهو علم حديث يقع عند تقاطع علم الأحياء والرياضيات حول تحليل تسلسل الجينات والبروتينات. يمكننا أخذ الجينوم البشري والفأري والعثور على جميع أقسام الحمض النووي المتشابهة فيهما. وتبين أن بعض أجزاء تسلسل النيوكليوتيدات في هذين النوعين متشابهة جدًا. على سبيل المثال، الجينات اللازمة لتوليف بروتينات الريبوسوم محافظة للغاية، أي أن الطفرات فيها ضارة بدرجة كافية بحيث يموت حاملو الطفرات الجديدة دون ترك ذرية. ويقال إن مثل هذه الجينات تخضع للانتقاء السلبي، مما يؤدي إلى تطهيرها من الطفرات الضارة. سيكون للمناطق الأخرى من الجينوم اختلافات كبيرة بين الأنواع، مما يشير إلى أن الطفرات في هذه المناطق من المحتمل أن تكون غير ضارة، وبالتالي فإن دورها الوظيفي صغير أو لا يحدده تسلسل نيوكليوتيدات محدد. قدر عدد من الدراسات نسبة مناطق الحمض النووي البشري تحت ضغط الاختيار السلبي. اتضح أن حوالي 6.5-10% فقط من الجينوم ينتمي إليهم، والمناطق غير المشفرة، على عكس المناطق المشفرة، أقل عرضة للاختيار السلبي. لقد اتضح أنه من وجهة نظر المعايير التطورية، فإن أقل من 10% من الجينوم البشري فعال. لاحظ مدى اقتراب أونو من هذا التقدير في عام 1972!
حصن القمامة


ولكن هل الـ90% المتبقية من الجينوم البشري هي في الحقيقة قمامة ومن الأفضل التخلص منها؟ ليس بالتأكيد بهذه الطريقة. هناك اعتبارات مفادها أن حجم الجينوم الكبير قد يكون مفيدًا في حد ذاته. في البكتيريا، يعد تكرار الجينوم عاملاً مقيدًا خطيرًا يتطلب إنفاقًا كبيرًا للطاقة. لذلك، عادة ما تكون جينوماتهم صغيرة، ويتخلصون من كل ما هو غير ضروري. في الكائنات الكبيرة، كقاعدة عامة، لا يساهم تكرار الحمض النووي للخلايا المنقسمة بشكل كبير في إجمالي كمية إنفاق الطاقة في الجسم على خلفية نفقات عمل الدماغ والعضلات وأعضاء الإخراج والحفاظ على درجة حرارة الجسم وما إلى ذلك. وفي الوقت نفسه، يمكن أن يكون الجينوم الكبير مصدرًا مهمًا للتنوع الجيني، مما يزيد من فرص ظهور مناطق وظيفية جديدة من المناطق غير الوظيفية بسبب الطفرات التي قد تكون مفيدة في عملية التطور. يمكن للعناصر القابلة للنقل أن تنقل العناصر التنظيمية، مما يخلق تنوعًا جينيًا في تنظيم وظيفة الجينات. وهذا يعني أن الكائنات الحية ذات الجينومات الكبيرة يمكنها نظريًا التكيف بشكل أسرع مع الظروف البيئية، مما يدفع تكاليف إضافية صغيرة نسبيًا لتكرار جينوم أكبر. لن نجد هذا التأثير في كائن حي فردي، لكنه قد يلعب دورًا مهمًا على مستوى السكان.
إن وجود جينوم كبير قد يقلل أيضًا من احتمالية قيام الفيروس بإدخال نفسه في جين وظيفي (مما قد يؤدي إلى فشل الجين، وفي بعض الحالات، السرطان). بمعنى آخر، من الممكن أن يعمل الانتقاء الطبيعي ليس فقط على الحفاظ على تسلسلات محددة في الجينوم، ولكن أيضًا على الحفاظ على أحجام معينة من الجينوم، وتكوين النوكليوتيدات في بعض مناطقه، وما إلى ذلك.
ومع ذلك، على الرغم من أن فكرة أن 80% أو حتى 20% فقط من الجينوم البشري فعال هي فكرة مثيرة للجدل، إلا أن هذا لا يعني أن مشروع ENCODE بأكمله عرضة للنقد. وفي إطار هذا البحث، تم الحصول على كمية هائلة من البيانات حول كيفية ارتباط البروتينات المختلفة بالحمض النووي، ومعلومات حول تنظيم الجينات، وما إلى ذلك. وهذه البيانات ذات أهمية كبيرة للمتخصصين. لكن من غير المرجح أن يكون من الممكن في المستقبل القريب التخلص من "القمامة" في الجينوم - المفهوم والتسلسلات غير الضرورية نفسها.
مقال لمسابقة “بيو/مول/نص”: هذا سؤال مثير للاهتمام كان من المفترض أن يجيب عليه مشروع الجينوم البشري، الذي انتهى عام 2003. وبعد أن حصل العلماء على معلومات أساسية عن الجينوم البشري، حاولوا تحديد عدد الجينات، لكن هذه المهمة لم تكن بهذه البساطة. الغرض من هذه المقالة هو تلخيص وتحليل البيانات العلمية حول تجميع كتالوج الجينات البشرية.
الراعي العام للمسابقة هو شركة Diaem: أكبر مورد للمعدات والكواشف والمواد الاستهلاكية للبحث والإنتاج البيولوجي.

وقد أقيمت جائزة الجمهور برعاية مركز الوراثة الطبية.

"كتاب" الراعي الرسمي للمسابقة - "ألبينا غير روائية"
كم هو قليل ما نعرفه عن الجينات! المرة الأولى التي شعرت فيها بهذا الأمر بشدة كانت أثناء ممارستي لمختبر علم الوراثة الطبية في جامعة هاربين الطبية. كانت المجموعة البحثية التي تدربت فيها تدرس الجين الورمي Sei-1، الذي يحفز تكوين كروموسومات مدتها دقيقتين (DM)، والتي تساهم في تطوير تكوين الأورام. ومع ذلك، فإن آلية تكوين الجين الورمي Sei-1 لا تزال مجهولة حتى يومنا هذا. لكن الطفرات الجينية المختلفة هي سبب أمراض بشرية خطيرة أخرى، بالإضافة إلى السرطان. لذلك، في هذه المقالة سوف نلخص بعض الأفكار حول سبب عدم معرفتنا الكثير عن الجينات، وسنقوم أيضًا بصياغة رأينا حول عدد الجينات التي يمتلكها الشخص.
مشروع الجينوم البشري وقائمة كاملة من الجينات
يعد تحديد قائمة كاملة من الجينات أمرًا ضروريًا لتوضيح الآليات الجزيئية لحدوث وتطور السرطان والفصام والخرف والعديد من الأمراض البشرية الأخرى. إن تسلسل الحمض النووي المعزول من أنسجة المريض يجعل من الممكن تحديد الطفرات مثل بدائل النوكليوتيدات والحذف والإدراج المسؤولة عن حدوث هذه الأمراض.
في الواقع، هذا هو السبب وراء بدء مشروع الجينوم البشري ( مشروع الجينوم البشري HGP) والتي استمرت من عام 1990 إلى عام 2003. وكانت مهمتها الرئيسية هي تحديد تسلسل النيوكليوتيدات في الحمض النووي البشري وموقع 100000 جين بشري (كما كان يعتقد آنذاك). وبالتوازي، تم التخطيط لدراسة الحمض النووي لمجموعة من الكائنات الحية النموذجية من أجل الحصول على المعلومات المقارنة اللازمة لفهم عمل الجينوم البشري. كان من المفترض أن تصبح المعلومات التي تم الحصول عليها نتيجة لبرنامج HGP كتابًا مرجعيًا للعلوم الطبية الحيوية في القرن الحادي والعشرين. كانت أهداف هذه الدراسات هي الحصول على معلومات حول أسباب مجموعة من الأمراض، وفي نهاية المطاف، تطوير علاجات لأكثر من 4000 مرض وراثي يؤثر على البشرية، بما في ذلك الأمراض المتعددة العوامل التي تلعب فيها القابلية الوراثية دورًا مهمًا. كان يعتقد أن نتائج تسلسل الجينوم ستسمح لنا بتحديد موقع كل جين وعددها الإجمالي. ومع ذلك، فقد أثبتت الأحداث اللاحقة العكس: يوجد اليوم العديد من قواعد بيانات الجينات التي تختلف بشكل كبير عن بعضها البعض. علاوة على ذلك، فإن عدد جينات ترميز البروتين يتطابق، لكن عدد جينات الأنواع الأخرى يتباين.
مشروع البروتيوم البشري
في عام 2010 بمبادرة من منظمة دراسة البروتيوم البشري ( منظمة البروتينات البشرية HUPO) تم البدء بمشروع "البروتيوم البشري" ( HPP) ، والذي يهدف إلى إنشاء قائمة كاملة من البروتينات الخاصة بالأنواع الإنسان العاقل. للقيام بذلك، أولاً، من المفترض تحديد وتوصيف منتج بروتيني واحد على الأقل من جينات ترميز البروتين، وتعدد أشكالها أحادية النوكليوتيدات ومتغيرات الربط، بالإضافة إلى أنواع التعديل بعد الترجمة للبروتينات. ثانيًا، تساهم البيانات البروتينية التي تم الحصول عليها نتيجة تنفيذ HPP، بالإضافة إلى البيانات الجينومية، في حل المشكلات الطبية الحيوية المختلفة وإنشاء قواعد معرفية مشروحة جديدة، مثل neXtProt .
حالياً neXtProtيحتوي على معلومات حول 17,487 بروتينًا تم تأكيد وجودها تجريبيًا، و1,728 بروتينًا تم تأكيدها على مستوى النسخ، و515 بروتينًا تم تحديدها على أساس التماثل، و76 بروتينًا متوقعًا، و571 بروتينًا غير معروف الطبيعة. ومما يثير الاهتمام بشكل خاص البروتينات التي لم يتم إثبات وجودها تجريبيًا، على الرغم من وجود أدلة على أنها مشفرة بواسطة الجينوم. هذه هي ما يسمى بالبروتينات "المفقودة"، والتي تشكل حوالي 18٪ من جميع البروتينات المشفرة. تم إنشاء مورد لتحديد وتوصيف هذه البروتينات مفقودة بروتين بيديا .
البروتين البشري هو استمرار لمشروع الجينوم البشري. ومن المتوقع أنه بفضل مشروع البحث البروتيني، سنتعرف على العدد الدقيق للجينات المشفرة للبروتين، مما سيسمح لنا لاحقًا بفهم عدد الجينات التي يمتلكها الشخص.
قليلا عن الحمض النووي الريبي
لقد أظهر مشروع الجينوم البشري أن جزيئات الحمض النووي الريبي (RNA) لا تقل أهمية عن الحمض النووي (DNA) للحياة. هناك العديد من RNAs داخل الخلايا (الشكل 2). في البداية، يتم تقسيم الحمض النووي الريبي (RNA) إلى RNAs غير المشفرة (ncRNA)، والتي لا تترجم إلى بروتينات، و ترميز RNAs (مرنا)، بمثابة مصفوفة لتخليق سلاسل البروتين ببتيد. تحتوي RNAs غير المشفرة على تصنيف أكثر تعقيدًا. فهي البنية التحتية والتنظيمية. البنية التحتية RNAيتم تمثيلها بواسطة الريبوسوم RNA (rRNA) ونقل RNA (tRNA). يتم تصنيع جزيئات الرنا الريباسي (rRNA) في النواة وتشكل أساس الريبوسوم، كما تقوم أيضًا بتشفير بروتينات الوحدات الفرعية للريبوسوم. بمجرد تجميع الرنا الريباسي بشكل كامل، فإنها تنتقل إلى السيتوبلازم، حيث تشارك، كمنظمين رئيسيين للترجمة، في قراءة كود الرنا المرسال. يشير تسلسل القواعد النيتروجينية الثلاثة في mRNA إلى إدراج حمض أميني محدد في تسلسل البروتين. تقوم جزيئات الحمض الريبي النووي النقال بنقل هذه الأحماض الأمينية إلى الريبوسومات، حيث يتم تصنيع البروتين.
اقرأ المزيد عن الحمض النووي الريبي (RNA) في مقالات "الجزيئات الحيوية": " عن كل الـ RNAs في العالم، كبيرها وصغيرها», « ترميز RNAs غير المشفرة" و " قوة الخواتم: RNAs الدائرية القديرة» .

الشكل 2. أنواع الحمض النووي الريبي
ncRNAs التنظيميةيتم تمثيلها على نطاق واسع جدًا في الجسم، وتصنف حسب الحجم وتؤدي عددًا من الوظائف المهمة (الجدول 1).
| اسم | تعيين | طول | المهام | |
|---|---|---|---|---|
| RNAs الطويلة غير المشفرة | lncRNA، lncRNA | 200 نيوكليوتيدات | 1. تنظيم مثيلة الحمض النووي الانتقائي عن طريق توجيه ميثيل ترانسفيراز الحمض النووي 2. يوجهون الزراعة الانتقائية للمجمعات القامعة بوليكومب |
|
| الحمض النووي الريبي الصغيرة | RNAs النووية الصغيرة | سنرنا، سنرنا | 150 نيوكليوتيدات | 1. المشاركة في الربط 2. تنظيم نشاط عوامل النسخ 3. الحفاظ على سلامة التيلومير |
| RNAs النووية الصغيرة | سنورنا، سنورنا | 60-300 نيوكليوتيدات | 1. المشاركة في التعديل الكيميائي للـ rRNA وtRNA وsnRNA 2. ربما يشارك في تثبيت بنية الرنا الريباسي (rRNA) والحماية من عمل الهيدروليزات |
|
| الحمض النووي الريبي المتداخل الصغير | ميرنا، سيرنا | 21-22 النيوكليوتيدات | 1. توفير الحماية المناعية المضادة للفيروسات 2. قمع نشاط جيناتهم |
|
| الحمض النووي الريبي الصغير | ميرنا، ميرنا | 18-25 نيوكليوتيدات | قمع الترجمة عن طريق تدخل الحمض النووي الريبي | |
| الحمض النووي الريبي المضاد للفيروسات | asRNA | 1. القصير: أقل من 200 نيوكليوتيدات 2. طويل: أكثر من 200 نيوكليوتيدات |
كتلة الترجمة عن طريق تشكيل الهجينة مع مرنا | |
| RNAs المرتبطة ببروتينات Piwi | بيرنا، بيويرنا | 26-32 نيوكليوتيدات | ويطلق عليهم أيضًا اسم "حراس الجينوم"، حيث يقومون بقمع نشاط العناصر الوراثية المتنقلة أثناء التطور الجنيني | |
مشكلة المصطلحات
قبل الإجابة على السؤال: "كم عدد الجينات لدينا؟"، عليك أن تفهم ما هو الجين؟
كان التركيز الرئيسي لـ HGP على جينات ترميز البروتين. ومع ذلك، كما جاء في تقرير HGP الأصلي في عام 2001، " تنتج الآلاف من الجينات البشرية RNAs غير المشفرة (ncRNAs)، وهي منتجاتها النهائية"، على الرغم من أنه كان معروفًا في ذلك الوقت حوالي 706 جينًا من جينات ncRNA. في مقال نشر مؤخرا في المجلة بي إم سي علم الأحياءستيفن سالزبيرج ( ستيفن إل سالزبيرج) يعطي التعريف التالي للجين:
الجين هو أي جزء من الحمض النووي الصبغي الذي يتم نسخه إلى جزيء RNA وظيفي أو يتم نسخه أولاً إلى RNA ثم ترجمته إلى بروتين وظيفي.
يتضمن هذا التعريف كلاً من جينات الحمض النووي الريبي (RNA) غير المشفرة وجينات ترميز البروتين، ويسمح بتعريف جميع متغيرات الربط البديلة في موضع واحد على أنها متغيرات لنفس الجين. هذا يسمح لك بالاستبعاد الجينات الكاذبة– البقايا غير الوظيفية للجينات الهيكلية التي فقدت قدرتها على تشفير البروتينات.
أشارت نتائج الدراستين الأوليين إلى وجود 31.000 و26.588 جينًا مشفرًا للبروتين لدى البشر، وفي عام 2004 ظهر التسلسل الكامل للجينوم البشري، وقدر المؤلفون أن الكتالوج الكامل يحتوي على 24000 جينًا مشفرًا للبروتين. كتالوج الجينات البشرية فرقةيتضمن 22287 جينًا لترميز البروتين و34214 نسخة.
تسلسل الجيل القادم (NGS)
ظهور أساليب الإنتاجية العالية التسلسل الموازي(في هذا النوع من التسلسل، يتم تسلسل ملايين أجزاء الحمض النووي من عينة واحدة في وقت واحد) أو تسلسل الجيل القادم (تسلسل الجيل القادم (NGS).) جعل من الممكن تسريع عملية البحث عن المناطق الوظيفية للجينوم بشكل كبير. قامت شركات التكنولوجيا الحيوية بتطوير وتسويق العديد من منصات تسلسل الغاز الطبيعي التي يمكنها التسلسل من مليون إلى عشرات المليارات من التسلسلات القصيرة (يقرأ، يقرأ) يبلغ طول كل منها 50-600 نيوكليوتيدات. تشمل المنصات الأكثر شعبية ما يلي: إلوميناو ايون تورنت، وذلك باستخدام تضخيم الحمض النووي بواسطة PCR، بالإضافة إلى منصات التسلسل أحادية الجزيء مثل هيليكوس للعلوم البيولوجية هيليسكوب, العلوم البيولوجية في المحيط الهادئ SMRT (تسلسل جزيء واحد في الوقت الحقيقي)، وتسلسل ثقب النانو أكسفورد نانوبور، والتي تقوم بالتسلسل في الوقت الفعلي وتسمح بقراءة قراءات أطول بشكل ملحوظ - ما يصل إلى 10-60 ألف نيوكليوتيدات. بالإضافة إلى ذلك، اختراع تسلسل الحمض النووي الريبي (RNA) RNA-seq) في عام 2008، والذي تم إنشاؤه لقياس التعبير الجيني، ساهم أيضًا في اكتشاف التسلسلات المكتوبة، سواءً RNA المشفر أو غير المشفر.
بفضل NGS، نمت قواعد بيانات lncRNAs وجينات RNA الأخرى (مثل microRNAs) بشكل كبير على مدار العقد، وتحتوي الآن كتالوجات الجينات البشرية الحالية على جينات ترميز RNA أكثر من جينات ترميز البروتين (الجدول 2).
| أنواع الجينات | جينكود | فرقة | مرجع | شطرنج |
|---|---|---|---|---|
| جينات ترميز البروتين | 19 901 | 20 376 | 20 345 | 21 306 |
| جينات RNA الطويلة غير المشفرة | 15 779 | 14 720 | 17 712 | 18 484 |
| الحمض النووي الريبي المضاد للفيروسات | 5501 | - | 28 | 2694 |
| RNAs غير المشفرة الأخرى | 2213 | 2222 | 13 899 | 4347 |
| الجينات الكاذبة | 14 723 | 1740 | 15 952 | - |
| العدد الإجمالي للنصوص | 203 835 | 203 903 | 154 484 | 323 827 |
كشف تسلسل الحمض النووي الريبوزي (RNA) أن الربط البديل، وبدء النسخ البديل، وإنهاء النسخ البديل تحدث بشكل متكرر أكثر بكثير مما كان يعتقد سابقًا، مما يؤثر على ما يصل إلى 95٪ من الجينات البشرية. لذلك، حتى لو كان موقع جميع الجينات معروفًا، يجب أولاً تحديد جميع الأشكال الإسوية لتلك الجينات وما إذا كانت هذه الأشكال الإسوية لها أي وظيفة أو تمثل ببساطة أخطاء الربط.
قواعد بيانات الجينات البشرية
لا تزال مهمة تجميع كتالوج لجميع الجينات لم يتم حلها بعد. تكمن المشكلة في أنه خلال الخمسة عشر عامًا الماضية، قامت مجموعتان بحثيتان فقط بتجميع قائمة بالجينات السائدة: مرجع والذي يدعمه المركز الوطني لمعلومات التكنولوجيا الحيوية ( نكبي) في المعاهد الوطنية للصحة ( المعاهد الوطنية للصحة)، و فرقة/جينكود ، والذي يدعمه المختبر الأوروبي للبيولوجيا الجزيئية ( إمبل). ومع ذلك، على الرغم من التقدم الكبير، فإن عدد جينات ترميز البروتين، وجينات الحمض النووي الريبي الطويلة غير المشفرة، والجينات الكاذبة في الكتالوجات يختلف الآن، كما يختلف أيضًا عدد RNAs المضاد للفيروس وRNAs غير المشفرة الأخرى (الجدول 2). لا تزال الفهارس قيد الانتهاء: في العام الماضي، على سبيل المثال، تمت إضافة أو إزالة مئات الجينات المشفرة للبروتين من القائمة جينكود. تفسر هذه الخلافات مشكلة إنشاء فهرس كامل للجينات البشرية.
في عام 2017، تم إنشاء قاعدة بيانات جديدة للجينات البشرية - شطرنج . والجدير بالذكر أنه يشمل جميع جينات ترميز البروتين مثل جينكود، لذا مرجع، لذلك المستخدمين شطرنجلا حاجة لتحديد قاعدة البيانات التي يفضلونها. المزيد من الجينات قد يسبب المزيد من الأخطاء، لكن المبدعين يعتقدون أن مجموعة أكبر ستكون مفيدة في دراسة الأمراض البشرية التي لم يتم تصنيفها بعد على أنها وراثية. مجموعة الجينات شطرنجحاليًا في الإصدار 2.0، لم يصبح نهائيًا بعد، ومن المؤكد أن المبدعين يعملون على تحسينه.